题目内容
5.工业常用Na2CO3饱和溶液回收NO、NO2气体:NO+NO2+Na2CO3═2NaNO2+CO2 2NO2+Na2CO3═NaNO3+NaNO2+CO2若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加3.6,则混合气体中NO和NO2体积比为3:5.分析 设出一氧化氮、二氧化氮的体积,然后根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答 解:设NO的物质的量是x,NO2的物质的量是y,
发生反应有:①NO+NO2+Na2CO3═2NaNO2+CO2、②2NO2+Na2CO3═NaNO3+NaNO2+CO2,
发生反应①NO为x,同时消耗二氧化氮的物质的量为x,则参加反应②的二氧化氮为y-x,则生成二氧化碳的物质的量为:x+$\frac{y-x}{2}$=$\frac{2.24}{22.4}$,
根据质量守恒定律可知,反应后溶液增加的质量为NO、NO2气体总质量-二氧化碳气体质量,即:30x+46y-$\frac{2.24}{22.4}$×44=3.6,
联立两个方程解得:x=$\frac{3}{40}$mol、y=$\frac{1}{8}$mol,
即:一氧化氮和二氧化氮的物质的量之比为:$\frac{3}{40}$mol:$\frac{1}{8}$mol=3:5,
所以相同条件下,一氧化氮和二氧化氮的体积之比是3:5,
故答案为:3:5.
点评 本题考查了混合物反应的计算,题目难度中等,明确质量守恒定律、差量法在化学计算中的应用,试题侧重考查学生的分析、理解能力能力及化学计算能力.

练习册系列答案
相关题目
15.我国酸雨形成的主要原因是( )
| A. | 汽车排出的大量尾气 | B. | 自然界中硫化物的分解 | ||
| C. | 工业上大量燃烧含硫的燃料 | D. | 制硝酸厂排出的大量尾气 |
16.医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的( )
| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
20.某对酸性溶液进行下列操作:①灼烧,火焰呈蓝色;②加BaCl2出现白色沉淀;③浓缩后加浓H2SO4和铜片共热产生红棕色气体,则此溶液中,可能存在的离子是( )
| A. | Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | B. | K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | ||
| C. | Na+、K+、SO${\;}_{3}^{2-}$ | D. | Na+、NO${\;}_{3}^{-}$、SO${\;}_{3}^{2-}$ |
2.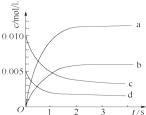 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.已知:K(300℃)>K(350℃),则该反应正反应是放热反应.升高温度,正反应速率增大(填“增大”、“减小”或“不变”).
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
19.下列说法正确的是( )
| A. | 分子式相同的不同物质一定是同分异构体 | |
| B. | 通式相同的不同物质一定属于同系物 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 分子式相同,元素的质量分数也相同的物质是同种物质 |