题目内容
13.下表是元素周期表的一部分,回答下列问题:(请用元素符号或化学式回答)| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式
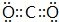 ;
;(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,金属性越强,与水反应越剧烈,非金属性越强,氢化物越稳定;
(2)氟元素没有最高价含氧酸,故高氯酸的酸性最强,上述元素中Na的金属性最强,故氢氧化钠碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(4)②形成单质为N2,①和③形成的酸性氧化物为CO2;
(5)同周期自左而右原子半径减小、同主族自上而下原子半径增大.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Si、⑨为P、⑩为S、⑪为Cl、⑫为Ar.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F元素非金属性最强,故Na与水反应最剧烈,氢化物中HF最稳定,
故答案为:Na;HF;
(2)氟元素没有最高价含氧酸,故HClO4的酸性最强,上述元素中Na的金属性最强,故NaOH碱性最强,
故答案为:HClO4;NaOH;
(3)⑤、⑦的最高价氧化物的对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)②形成单质为N2,结构式为N≡N,①和③形成的酸性氧化物为CO2,电子式为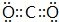 ,故答案为:N≡N;
,故答案为:N≡N;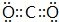 ;
;
(5)同周期自左而右原子半径减小、同主族自上而下原子半径增大,上述元素中原子半径最大的非金属元素的原子是Si,故答案为:Si.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,有利于基础知识的巩固.

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
| A. | 桶烯分子中所有原子在同一平面内 | |
| B. | 桶烯在一定条件下能发生加成反应和聚合反应 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯中的一个氢原子被氯原子取代,所得产物只有一种 |
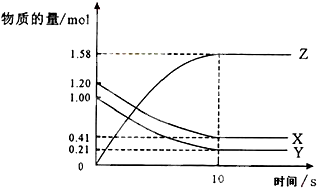 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应进行到第10S时,该反应就达到了平衡状态 | |
| B. | 前10S,用Z表示的反应速率为0.158 mol/(L•S) | |
| C. | 反应进行到第8S时,反应速率v(Z)>v(X)>v(Y) | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
| A. | 制溴苯时,将导气管插入水中使其充分吸收尾气 | |
| B. | 配制新制Cu(OH)2悬浊液:在一定量CuSO4溶液中,滴加少量NaOH溶液 | |
| C. | 只用溴水一种试剂可鉴别出甲苯、己烯、乙醇、四氯化碳四种液体 | |
| D. | 制取乙酸乙酯实验中,在一定量乙醇中,依次加入0.5mol/L的H2SO4和乙酸后加热 |
| A. | NaOH | B. | CO2 | C. | C | D. | SiO2 |
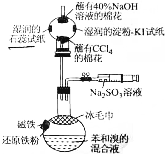 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应. ,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
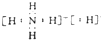 .
.