题目内容
2.下列操作正确的是( )| A. | 制溴苯时,将导气管插入水中使其充分吸收尾气 | |
| B. | 配制新制Cu(OH)2悬浊液:在一定量CuSO4溶液中,滴加少量NaOH溶液 | |
| C. | 只用溴水一种试剂可鉴别出甲苯、己烯、乙醇、四氯化碳四种液体 | |
| D. | 制取乙酸乙酯实验中,在一定量乙醇中,依次加入0.5mol/L的H2SO4和乙酸后加热 |
分析 A.制取溴苯时应防止倒吸;
B.氢氧化钠应稍过量;
C.甲苯、四氯化碳不溶于水,二者密度不同,乙烯发生加成反应,乙醇易溶于水;
D.浓硫酸稀释放出大量的热,注意防止酸液飞溅.
解答 解:A.制取溴苯时同时生成HBr,HBr易溶于水,应防止倒吸,故A错误;
B.如滴加少量氢氧化钠,生成少量氢氧化铜,不一定生成沉淀,且氧化性较弱,不能氧化醛基,氢氧化钠应稍过量,故B错误;
C.甲苯、四氯化碳不溶于水,二者密度不同,乙烯发生加成反应,可使溴水褪色,乙醇易溶于水,现象各不相同,可鉴别,故C正确;
D.应先加乙醇,再加浓硫酸,最后加乙酸,防止酸液飞溅,故D错误.
故选C.
点评 本题综合考查有机物的检验、有机物的制备等知识,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
12.下列各反应属于加成反应的是( )
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 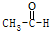 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
13.下表是元素周期表的一部分,回答下列问题:(请用元素符号或化学式回答)
(1)在这些元素中,与水反应最剧烈的金属元素是Na;元素的气态氢化物最稳定的物质是HF.
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式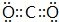 ;
;
(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式
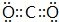 ;
;(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
10.下列叙述正确的是( )
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| C. | 镀层破损后,镀锡铁片比镀锌铁片更耐腐蚀 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
7.在人类已知的化合物中,种类最多的是( )
| A. | 过渡元素形成的化合物 | B. | ⅢA族元素形成的化合物 | ||
| C. | ⅣA族元素形成的化合物 | D. | ⅦA族元素形成的化合物 |
11.关于下列各装置的叙述不正确的是( )
| A. |  如图装置可用于制备乙酸乙酯 | |
| B. |  如图装置可用于模拟海水蒸馏 | |
| C. |  如图装置可用于探究碳酸氢钠的热稳定性 | |
| D. |  如图装置为配制溶液过程中的定容操作 |
12.观察图:对合成氨反应中,下列叙述错误的是( )


| A. | 开始反应时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| C. | 反应到达t1时,正反应速率与逆反应速率相等,反应停止 | |
| D. | 反应在t1之后,正反应速率与逆反应速率相等,反应达到化学平衡状态 |
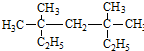 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷;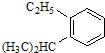 的芳香炔烃的结构简式
的芳香炔烃的结构简式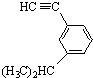 ;
;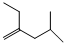 .
.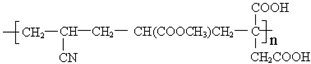
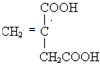 ;
; .
.