题目内容
14.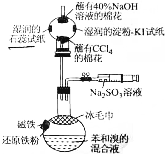 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.实验步骤如下:
①按图所示组装仪器并检查装置的气密性;
②将磁铁用双面胶固定在圆底烧瓶外侧顶部,取0.5g还原铁粉置于瓶内,移动烧瓶使铁粉被磁铁吸于瓶内侧顶端.在干燥管球内尖端部位放一团蘸有40%氢氧化钠溶液的棉花,两侧分别放一段湿润的石蕊试纸和湿润的淀粉碘化钾试纸,再将另一团蘸有CCl4的棉花松松地置于干燥管的管口,塞上带有导管的胶塞.
③将磁石移开,并用冰毛巾覆盖在圆底烧瓶上半部分.
④反应完毕后,打开止水夹,立即将注射器中10mL饱和的亚硫酸钠溶液注入烧瓶中,充分反应后,上层为浅绿色溶液,下层为接近无色油状液体.再用注射器注入蒸馏水“水洗”,即可清楚地看到无色溴苯生成,请回答相关问题.
(1)步骤②中蘸有CCl4的棉花和蘸有40%氢氧化钠溶液的棉花的作用分别为吸收挥发苯与溴、吸收HBr,防止污染环境;
(2)步骤③中,苯和溴反应的化学方程式为
 ,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;(3)步骤④中,饱和的亚硫酸钠溶液的主要作用是消耗掉未反应的溴,防止污染环境,生成浅绿色溶液的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,从“水洗”后的体系中分离出溴苯的操作是分液;
(4)什么现象能证明苯和溴发生的是取代反应湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色;
(5)该实验的优点有防止造成环境污染、实验同时证明苯和溴发生的是取代反应等.
分析 (1)苯与溴易挥发,用四氯化碳吸收;反应生成HBr,用NaOH溶液吸收,防止污染环境;
(2)苯与溴在Fe作催化剂条件下反应生成溴苯与HBr;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用;
(3)亚硫酸钠具有还原性,可以消耗掉未反应的溴;反应中起催化剂作用物质实际是FeBr3,三价铁具有氧化性,可以与亚硫酸钠发生氧化反应生成亚铁离子、硫酸根;溴苯与水溶液不互溶,利用分液的方法进行分离;
(4)利用湿润的淀粉-KI试纸排除溴使湿润的石蕊试变色,再利用湿润的石蕊试纸验证有HBr;
(5)该实验防止环境污染、实验同时可以证明苯和溴发生的是取代反应.
解答 解:(1)苯与溴易挥发,用四氯化碳吸收,防止对环境污染、防止溴对HBr检验的影响,由于反应生成HBr,且易挥发,用NaOH溶液吸收,防止污染环境,
故答案为:吸收挥发苯与溴;吸收HBr,防止污染环境;
(2)苯与溴在Fe作催化剂(实际为溴化铁)条件下反应生成溴苯与HBr,反应方程式为: ;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用,减少原料的损失,
;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用,减少原料的损失,
故答案为: ;降低温度圆底烧瓶上部温度,起冷却回流作用;
;降低温度圆底烧瓶上部温度,起冷却回流作用;
(3)亚硫酸钠具有还原性,可以消耗掉未反应的溴,防止污染环境;反应中起催化剂作用物质实际是FeBr3,三价铁具有氧化性,可以与亚硫酸钠发生氧化反应生成亚铁离子、硫酸根,反应离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;溴苯与水溶液不互溶,从“水洗”后的体系中分离出溴苯的操作是分液,
故答案为:消耗掉未反应的溴,防止污染环境;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;分液;
(4)湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色,说明反应生成HBr,可以证明证明苯和溴发生的是取代反应,
故答案为:湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色;
(5)该实验的优点有:防止造成环境污染、实验同时证明苯和溴发生的是取代反应等,
故答案为:防止造成环境污染、实验同时证明苯和溴发生的是取代反应等.
点评 本题考查制备实验方案,侧重对操作的分析评价考查,明确原理是解题关键,是对学生综合能力的考查,难度中等.

| A. | 醛基的结构简式-COH | B. | 乙烯的结构简式 C2H4 | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型 |
| A. |  制取少量氨气 | B. |  可制的金属铁 | ||
| C. |  制乙酸乙酯 | D. |  验证混合气体中一定含有乙烯 |
| A. | 盐酸 | B. | 硝酸 | C. | 氢氧化钠溶液 | D. | 浓硫酸 |
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 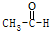 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式
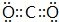 ;
;(5)在这些元素中,原子半径最大的非金属元素的原子是Si.