题目内容
5.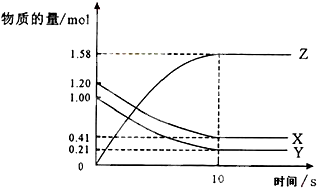 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应进行到第10S时,该反应就达到了平衡状态 | |
| B. | 前10S,用Z表示的反应速率为0.158 mol/(L•S) | |
| C. | 反应进行到第8S时,反应速率v(Z)>v(X)>v(Y) | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
分析 根据图可知知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,说明X和Y是反应物、Z是生成物,参加反应的△n(X)=(1.20-0.41)mol=0.79mol、△n(Z)=(1.58-0)mol=1.58mol、△n(Y)=(1.00-0.21)mol=0.79mol,同一反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比为0.79mol:0.79mol:1.58mol=1:1:2,则该反应方程式为X(g)+Y(g)?2Z(g),
A.反应体系中各物质的量不变时,该反应达到平衡状态;
B.反应速率=$\frac{\frac{△n}{V}}{△t}$;
C.同一时间,反应速率之比等于其计量数之比;
D.其反应方程式为X(g)+Y(g)?2Z(g).
解答 解:根据图可知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,说明X和Y是反应物、Z是生成物,参加反应的△n(X)=(1.20-0.41)mol=0.79mol、△n(Z)=(1.58-0)mol=1.58mol、△n(Y)=(1.00-0.21)mol=0.79mol,同一反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比为0.79mol:0.79mol:1.58mol=1:1:2,则该反应方程式为X(g)+Y(g)?2Z(g),
A.反应体系中各物质的量不变时,该反应达到平衡状态,根据图片知,反应到10s时,各物质物质的量不变,该反应达到平衡状态,故A正确;
B.反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.58}{2}}{10}$ mol/(L•s)=0.079 mol/(L•s),故B错误;
C.同一时间,反应速率之比等于其计量数之比,所以X、Y、Z的反应速率之比为1:1:2,则v(Z)>v(X)=v(Y),故C错误;
D.其反应方程式为X(g)+Y(g)?2Z(g),故D错误;
故选A.
点评 本题考查图象分析,侧重考查学生获取信息、利用信息解答问题能力,熟悉反应速率公式、反应速率与计量数的关系、物质的量变化量与计量数关系等即可解答,题目难度中等.

| A. | 将甲烷和乙烯的混合气体通过酸性高锰酸钾溶液,可除去乙烯 | |
| B. | 配制银氨溶液:在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解为止 | |
| C. | 验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液 | |
| D. | 无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式
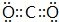 ;
;(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
| A. | HCOOCH3 | B. |  | ||
| C. |  | D. |  |
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| C. | 镀层破损后,镀锡铁片比镀锌铁片更耐腐蚀 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| A. | 可吸入颗粒 | B. | 氮气 | C. | 氧气 | D. | 二氧化碳 |
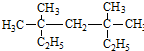 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷;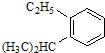 的芳香炔烃的结构简式
的芳香炔烃的结构简式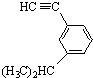 ;
;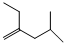 .
.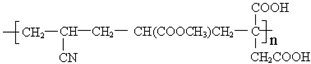
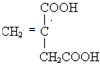 ;
; .
.