题目内容
8.原子序数依次增大的A、B、C、D都是元素周期表中短周期元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍.D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水.根据以上信息,回答下列问题:(1)D元素在元素周期表中的位置为第3周期ⅥA族,A和B形成化合物的化学式是Na2O或Na2O2
(2)高温时,C的单质跟Fe2O3发生反应的化学方程式2Fe2O3+6Al$\frac{\underline{\;高温\;}}{\;}$3 Al2O3+4Fe.
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-=Al02-+2H2O.
分析 原子序数依次增大的A、B、C、D都是元素周期表中短周期元素,A的原子结构中最外层电子数是电子层数的3倍,最外层电子数不超过8个,第一电子层最多排列2个电子,所以A的电子层数是2,最外层电子数是6,则A是O元素;A和D同主族,所以D是S元素;B、C、D同周期,D的最高价氧化物对应的水化物为硫酸,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水应是氢氧化铝与强碱、强碱的反应,故B为Na,C为Al元素,据此解答.
解答 解:原子序数依次增大的A、B、C、D都是元素周期表中短周期元素,A的原子结构中最外层电子数是电子层数的3倍,最外层电子数不超过8个,第一电子层最多排列2个电子,所以A的电子层数是2,最外层电子数是6,则A是O元素;A和D同主族,所以D是S元素;B、C、D同周期,D的最高价氧化物对应的水化物为硫酸,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水应是氢氧化铝与强碱、强碱的反应,故B为Na,C为Al元素.
(1)D为S元素,在元素周期表中的位置为:第3周期ⅥA族,A和B形成化合物的化学式是Na2O或Na2O2,
故答案为:第3周期ⅥA族;Na2O或Na2O2;
(2)高温时,C的单质跟Fe2O3发生反应的化学方程式:2Fe2O3+6Al$\frac{\underline{\;高温\;}}{\;}$3 Al2O3+4Fe,
故答案为:2Fe2O3+6Al$\frac{\underline{\;高温\;}}{\;}$3 Al2O3+4Fe;
(3)C、B的最高价氧化物对应的水化物分别为Al(OH)3、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=Al02-+2H2O,
故答案为:Al(OH)3+OH-=Al02-+2H2O.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,侧重对基础知识的巩固,注意对基础知识的理解掌握.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 盐酸 | B. | 硝酸 | C. | 氢氧化钠溶液 | D. | 浓硫酸 |
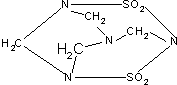
| A. | 毒鼠强属于无机物 | B. | 毒鼠强属于烃 | ||
| C. | 毒鼠强为高分子化合物 | D. | 毒鼠强为有机物 |
| A. | 将甲烷和乙烯的混合气体通过酸性高锰酸钾溶液,可除去乙烯 | |
| B. | 配制银氨溶液:在一定量AgNO3溶液中,逐滴滴加稀氨水至沉淀恰好溶解为止 | |
| C. | 验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液 | |
| D. | 无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
| A. | FeCl3溶液、溴水 | B. | Na2CO3溶液、溴水 | ||
| C. | 酸性KMnO4溶液、溴水 | D. | 酸性KMnO4溶液、FeCl3溶液 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式
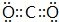 ;
;(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
| A. | HCOOCH3 | B. |  | ||
| C. |  | D. |  |
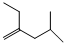
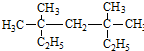 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷;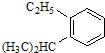 的芳香炔烃的结构简式
的芳香炔烃的结构简式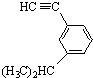 ;
; .
.
 ;
; .
. .
.