题目内容
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
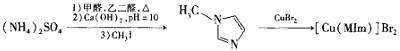
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
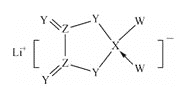
(2)与![]() 互为等电子体的阴离子为_______。
互为等电子体的阴离子为_______。
(3)![]() 中心原子的杂化方式为_________。
中心原子的杂化方式为_________。
(4)MIm中含σ键与π数目之比为__________。
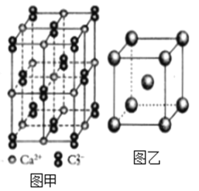
(5)一种铜的溴化物晶胞结构如图所示。
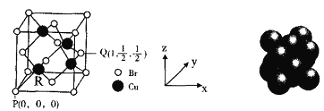
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。
(6)Cu晶体的堆积方式为面心立方最密堆积,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为_______________。
【答案】ⅠB 1s22s22p63s23p63d9或[Ar]3d9 ![]() (或其它合理答案) sp3 9:2 (
(或其它合理答案) sp3 9:2 (![]() ,
,![]() ,
,![]() ) 12 74.76%
) 12 74.76%
【解析】
(1)Cu失电子时,先失4s电子;
(2)等电子体具有相同的原子数和价电子总数;
(3)中心原子的杂化方式可根据价层电子对数的计算结果作出判断;
(4)MIm结构为![]() ,含2个双键、7个单键,依此可计算σ键和π键数;
,含2个双键、7个单键,依此可计算σ键和π键数;
(5)可将该晶胞切成完全相同的8个小平行六面体,R便在小平行六面体的体心,依此可判断其原子坐标;
(6)利用均摊法计算该晶胞所含各种粒子的个数,并计算出Cu的总体积;晶体中距离最近的原子可视着相切,根据这点可计算出晶胞的体积,进一步便可计算出空间利用率。
(1)铜元素原子序数为29,位于周期表中第四周期、ⅠB族,所以Cu电子数为29,基态Cu2+的电子排布式为1s22s22p63s23p63d9或[Ar]3d9。答案为:ⅠB;1s22s22p63s23p63d9或[Ar]3d9
(2)![]() 含5个原子、价电子数为8,所以与之互为等电子体的阴离子有
含5个原子、价电子数为8,所以与之互为等电子体的阴离子有![]() 或
或![]() 等离子。答案为:
等离子。答案为:![]() (或其它合理答案)
(或其它合理答案)
(3)![]() 中,价层电子对数=
中,价层电子对数= ![]() (中心原子的价电子数+配位原子的成键电子数±电荷数)=
(中心原子的价电子数+配位原子的成键电子数±电荷数)= ![]() (6+2)=4,杂化轨道数4,采取sp3杂化。答案为:sp3
(6+2)=4,杂化轨道数4,采取sp3杂化。答案为:sp3
(4)MIm结构为![]() ,分子中双键数2,其中π键数目为2,σ键数目为2;单键数为7,均为σ键。所以σ键总数为7+2=9,Mlm中含σ键与π数目之比为9:2。答案为:9:2
,分子中双键数2,其中π键数目为2,σ键数目为2;单键数为7,均为σ键。所以σ键总数为7+2=9,Mlm中含σ键与π数目之比为9:2。答案为:9:2
(5)图中P点坐标参数(0,0,0)和Q点原子坐标参数(1,![]() ,
,![]() ),可将晶胞边长设为1,PR点为晶胞对角线的
),可将晶胞边长设为1,PR点为晶胞对角线的![]() ,则可确定R点的原子坐标参数为(
,则可确定R点的原子坐标参数为(![]() ,
,![]() ,
,![]() )。答案为:(
)。答案为:(![]() ,
,![]() ,
,![]() )
)
(6)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;以顶点Cu原子进行研究,与之相邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故Cu原子配位数为![]() ;晶胞中Cu原子数目为8×
;晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,设Cu原子半径为a,则Cu原子总体积为4×
=4,设Cu原子半径为a,则Cu原子总体积为4× ![]() πa3,晶胞棱长=4a×
πa3,晶胞棱长=4a×![]() =2
=2![]() a,晶胞体积为(2
a,晶胞体积为(2![]() a)3,晶胞空间利用率=
a)3,晶胞空间利用率=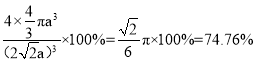 =
= ![]() =74.76%。答案为:12;74.76%
=74.76%。答案为:12;74.76%

 一线名师提优试卷系列答案
一线名师提优试卷系列答案