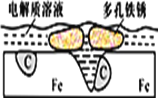
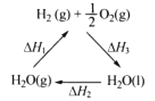
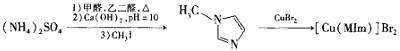题目内容
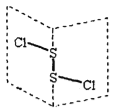
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
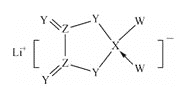
A.W的非金属性比Y的强 B.在该物质中Ⅹ原子满足8电子稳定结构
C.该物质中含离子键和共价键 D.Z的氧化物都易溶于水中
【答案】D
【解析】
“Y的最外层电子数是X次外层电子数的3倍”则X次外层电子数为2,Y的最外层电子数为6,因此Y为O;由盐的结构简式可知,Z的最外层电子数为4,且能与O形成双键,因此Z为C;X能形成三个化学键,且能提供空轨道,因此X为B;四种元素位于同周期,且W能形成一个化学键,因此W为F;据此结合选项进行分析。
A.由分析可知,W为F、Y为O,非金属性F>O,故A正确;
B.在该物质中,X原子满足8电子稳定结构,故B正确;
C.由该物质的结构可知,该物质中含有离子键和共价键,故C正确;
D.Z的氧化物为CO2或CO,其中CO不溶于水,故D错误;
故答案为:D。

 名校课堂系列答案
名校课堂系列答案【题目】某无色澄清溶液中Cl-浓度为0.5 mol·L-1,还可能含有下表中的若干种离子。
阳离子 | K+、Al3+、Mg2+、Ba2+、Fe3+ |
阴离子 | NO3-、CO32-、SiO32-、SO42-、OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)通过以上实验不能确定是否存在的离子有______________。能确定一定不存在的离子是_____________________________________________________。
(2)实验Ⅰ中生成沉淀的离子方程式为_____________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子______________ (不一定要填满)。
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________________。
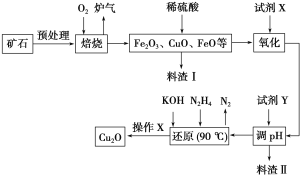
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。