题目内容
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
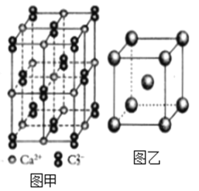
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
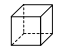
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
【答案】第四周期 Ⅷ族 [Ar]3d5或1s22s22p63s23p63d5 AB K<C<O<N sp sp2 2:1 4 分子 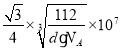
【解析】
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,据此确定其在周期表的位置;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+;
(2)根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①KCNO由K、C.N、O四种元素组成,K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低;
②丙烯腈(H2C=CHC≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,CH都是σ键,确定分子中σ键和π键数目,再求出比值;
(4)1个Ca2+周围距离最近且等距离的C22应位于同一平面,注意使晶胞沿一个方向拉长的特点;
(5)Fe(CO)5的熔点、沸点均不高,类似于分子晶体的特点;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,晶胞体积V=
g,晶胞体积V=![]() cm3、边长a=
cm3、边长a=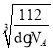 cm,根据Fe原子半径r与晶胞边长a关系求出r。
cm,根据Fe原子半径r与晶胞边长a关系求出r。
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,位于第四周期Ⅷ族据;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+,所以基态Fe3+核外电子排布式为) [Ar]3d5或1s22s22p63s23p63d5故答案为:第四周期Ⅷ族,[Ar]3d5或[Ar]3d5或1s22s22p63s23p63d5;
(2)[Fe(CN)6]3是阴离子,是配合物的内界,含有配位键和极性共价键,金属键存在于金属晶体中,氢键是分子间作用力,不是化学键,故选AB;故答案为:AB;
(3)①KCNO中K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低,所以第一电离能大于O,C的非金属性小于O,第一电离能小于O,所以第一电离能由小到大排序为K<C<O<N;故答案为:K<C<O<N;
②丙烯腈(H2C=CHC≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,CH都是σ键,所以分子中σ键和π键数目分别为6、3,σ键和π键数目之比为6:3=2:1;故答案为:sp、sp2;2:1;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22不是6个,而是4个,故答案为:4;
(5)根据Fe(CO)5的熔点、沸点均不高的特点,可推知Fe(CO)5为分子晶体;故答案为:分子;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,晶胞体积V=
g,晶胞体积V=![]() cm3、边长a=
cm3、边长a=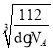 cm,Fe原子半径r与晶胞边长a关系为4r=
cm,Fe原子半径r与晶胞边长a关系为4r=![]() a,所以r=
a,所以r=![]() a=
a=![]()
![]()
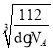 cm=
cm=![]()
![]()
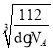 ×107nm;故答案为:
×107nm;故答案为:![]()
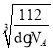 ×107。
×107。