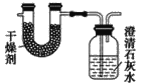
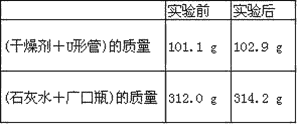
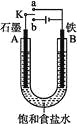
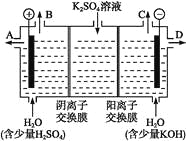
题目内容
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
【答案】C
【解析】
A、氯气能将铁和亚铁氧化;
B、根据合金的性质判断;
C、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,产物仍然呈碱性;
D、利用无水氯化钴和氯化钴晶体的颜色不同。
A、铁和亚铁能将氯气还原为氯离子,从而除去工业废气中的氯气,故A不选;
B、根据铝合金的性质,铝合金具有密度低、强度高,故可应用于航空航天等工业,故B不选;
C、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,产物仍然呈碱性,不能改变土壤的碱性,反而使土壤更板结,故C选;
D、利用无水氯化钴和氯化钴晶体的颜色不同,故可根据颜色判断硅胶中是否能吸水,故D不选。
故选C。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【题目】某无色澄清溶液中Cl-浓度为0.5 mol·L-1,还可能含有下表中的若干种离子。
阳离子 | K+、Al3+、Mg2+、Ba2+、Fe3+ |
阴离子 | NO3-、CO32-、SiO32-、SO42-、OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)通过以上实验不能确定是否存在的离子有______________。能确定一定不存在的离子是_____________________________________________________。
(2)实验Ⅰ中生成沉淀的离子方程式为_____________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子______________ (不一定要填满)。
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________________。