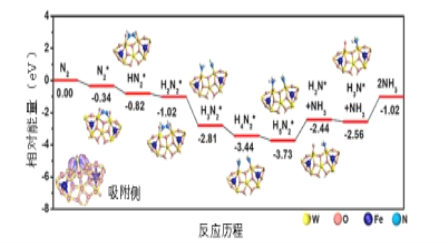
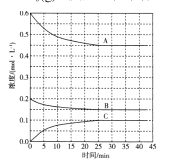
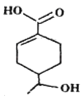
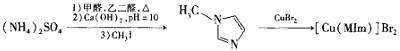��Ŀ����
����Ŀ�����ڱ��е�����Ԫ��A��B��D��E��F��ԭ��������������A�Ļ�̬ԭ�Ӽ۲�����Ų�Ϊnsnnpn��B�Ļ�̬ԭ��2p�ܼ���3�������ӣ�D��һ�ָ����ں�ˮ�е�Ԫ�أ�����λ�ں�ˮ�и�Ԫ�صĵ���λ��E2+��3d�������10�����ӣ�Fλ�ڵ������ڣ���Cuͬ�壬�䵥���ڽ������˳���������ĩλ��
��1��д��E�Ļ�̬ԭ�ӵļ۲�����Ų�ʽ___________��
��2��A��B�γɵ�AB������Ϊ��λ�������е����壬��Aԭ�ӵ��ӻ���ʽΪ________��AB���к��е���������������Ŀ֮��Ϊ________��
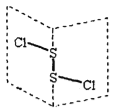
��3��FD3��һ�ֺֺ�ɫ���壬��ʪ�Լ�ǿ��������ˮ���Ҵ��������ǹ�̬��������̬���������Զ�����F2D6����ʽ���ڣ�����������Ϣ�ж�FD3������Ľṹ����____���壬д��F2D6�Ľṹʽ________��
��4��E��F������AB���γ������ӣ���֪E��AB���γɵ�������Ϊ���������Ρ�F(+1��)��AB�γɵ�������Ϊֱ���Σ���ҵ�ϳ���F��AB���γɵ���������E��Ӧ����ȡF���ʣ�д��E�û�F�����ӷ���ʽ_________________��
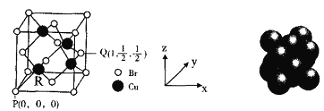
��5��F���ʵľ���Ϊ�����������ܶѻ�����F��ԭ�Ӱ뾶Ϊa nm��F���ʵ�Ħ���ĵ�����ΪMg/mol�������ӵ�����ΪNA����F���ʵ��ܶ�Ϊ______g/cm3��(��a��NA��M�Ĵ���ʽ��ʾ)
���𰸡�3d104s2 sp 1��2 ���� 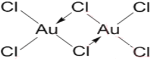 Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2- ![]()
��������
���ڱ��е�����Ԫ��A��B��D��E��F��ԭ��������������A�Ļ�̬ԭ�Ӽ۲�����Ų�Ϊnsnnpn����ônֻ��Ϊ2����A�Ļ�̬ԭ�Ӽ۲�����Ų�Ϊ2s2p2��AΪCԪ�أ�B�Ļ�̬ԭ��2p�ܼ���3�������ӣ���ôB�ļ۲�����Ų�ʽΪ2s22p3��B��NԪ�أ�D��һ�ָ����ں�ˮ�е�Ԫ�أ�����λ�ں�ˮ�и�Ԫ�صĵ���λ����ôD��ClԪ�أ�E2+��3d�������10�����ӣ�E��ZnԪ�أ�Fλ�ڵ������ڣ���Cuͬ�壬�䵥���ڽ������˳���������ĩλ��F��Au�����ڴ˻������������ʽṹ����֪ʶ���С�⡣
���ݷ�����A��B��D��E��F�ֱ�ΪC��N��Cl��Zn��Au��
(1)E��пԪ�أ��˵����Ϊ30����Ԫ�����ڱ��е�λ��Ϊ�������ڢ�B�壬E�Ļ�̬ԭ�ӵļ۲�����Ų�ʽ3d104s2����Ϊ��3d104s2
(2)A��B�γɵ�AB-����CN-��Cԭ�ӵļ۲���Ӷ���Ϊ1+(4+1-1��3)/2=2��Ϊsp�ӻ���CN-����һ������������һ��Ϊ����������2��Ϊ�м���������м�����Ŀ֮��Ϊ1��2����Ϊ��sp��1��2
(3)AuCl3��һ�ֺֺ�ɫ���壬��ʪ�Լ�ǿ��������ˮ���Ҵ����Զ�����Au2Cl6����ʽ���ڣ���2��AuCl3Ӧͨ����λ����ϣ�AuΪ����ԭ�ӣ�ClΪ��λԭ�ӣ��γɵĶ�����Au2Cl6Ϊ���ӣ����Կ��ж�AuCl3�������ڷ��Ӿ��壬�ṹʽΪ�� ����Ϊ�����ӣ�
����Ϊ�����ӣ�
(4)Au(+1��)��CN-�γɵ�ֱ����������Ϊ[Au(CN)2]-��Zn��CN-�γɵ�����������������Ϊ [Zn(CN)4]2-����Zn��ȡAu���ʵķ�Ӧ���û���Ӧ�����ӷ���ʽΪ��Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-����Ϊ��Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
(5)F�� Au���䵥�ʵľ���Ϊ�����������ܶѻ���ÿһ��Au�ľ����к���4��Auԭ�ӣ�ÿһ������������Ϊ![]() ������
������ =
=![]() g cm-3������
g cm-3������![]()

 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�