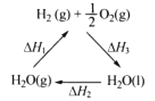
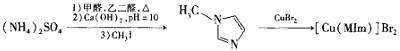题目内容
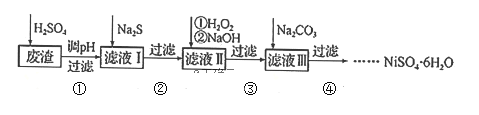
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
已知:①![]() 是一种不溶于水易溶于强酸的沉淀;②已知
是一种不溶于水易溶于强酸的沉淀;②已知![]() ,
,![]() 的
的![]() 。
。
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是___________。若在![]() 时,调pH=4除去铁,此时溶液中
时,调pH=4除去铁,此时溶液中![]() ______________。
______________。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是_ ___(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
【答案】第四周期,第Ⅷ族 H-O-O-H Cu2++ S2-=CuS↓ 避免生成H2S,影响除杂 防止H2O2受热分解 2.64![]() 10-9mol/L AE
10-9mol/L AE
【解析】
本题将工艺流程与氧化还原、电解池、沉淀溶解平衡相互结合,第一步操作为溶解金属,第二步为除去Cu2+和![]() ,第三步除去Fe和Cr,最后得到
,第三步除去Fe和Cr,最后得到![]() ,在各个步骤中结合氧化还原等一些应用。
,在各个步骤中结合氧化还原等一些应用。
(1)根据元素的排列规律及Ni的原子序数为28,可知Ni的位置为:第四周期第Ⅷ族;H2O2为分子晶体,原子之间均以共价单键相连,故的结构式为:H-O-O-H;
故答案为:第四周期第Ⅷ族;H-O-O-H;
(2)S2-与Cu2+和![]() 结合可生成沉淀,所以用
结合可生成沉淀,所以用![]() 溶液的目的是除去Cu2+和Zn2+,则除去Cu2+的离子方程式为:Cu2++ S2-=CuS↓;S2-可与结合生成弱电解质H2S,所以前一步在调节溶液的pH不能太低,否则会生成杂质H2S,影响除杂;
溶液的目的是除去Cu2+和Zn2+,则除去Cu2+的离子方程式为:Cu2++ S2-=CuS↓;S2-可与结合生成弱电解质H2S,所以前一步在调节溶液的pH不能太低,否则会生成杂质H2S,影响除杂;
故答案为:Cu2++ S2-=CuS↓ ;避免生成H2S,影响除杂;
(3)步骤③除去Fe采用生成![]() 的方式,在第一步酸溶时,铁变成Fe2+,因此该处需要氧化剂,发生氧化还原反应,温度太高,氧化剂H2O2分解;由于存在沉淀溶解平衡:
的方式,在第一步酸溶时,铁变成Fe2+,因此该处需要氧化剂,发生氧化还原反应,温度太高,氧化剂H2O2分解;由于存在沉淀溶解平衡:![]() ,平衡常数
,平衡常数![]() ,已知pH=4,则
,已知pH=4,则![]() ,公式换算可得:
,公式换算可得:![]() ;
;
故答案为:防止H2O2受热分解;![]() ;
;
(4)用电解法制备高纯度镍,原理同于制备高纯度铜,粗镍做阳极,活泼金属在阳极放电,该处在阳极反应的金属有Fe、Zn, 失去电子生成Fe2+、Zn2+,Cu和Pt作为阳极泥,在电解槽的底部,阴极发生的电极反应式为:![]() ,虽然阴极阳极都是2e-,但Fe、Zn和Cu本身的质量不一样,所以阳极减少的质量不等于阴极生成的质量,所以选AE,
,虽然阴极阳极都是2e-,但Fe、Zn和Cu本身的质量不一样,所以阳极减少的质量不等于阴极生成的质量,所以选AE,
故答案为:AE。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
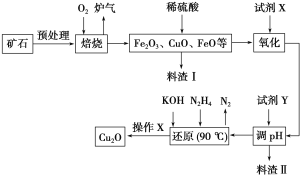
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
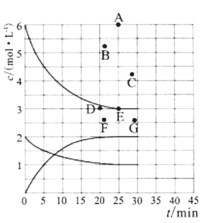
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。