题目内容
【题目】氨在化肥生产、储氢及环境治理等领域发挥着重要作用。
(1)中科院固体研究所的赵惠军和张海民研究团队以MoS2为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图1。将Na2SO4溶液换成Li2SO4溶液后,反应速率明显加快的主要原因是加快了下列__转化的反应速率(填标号)。
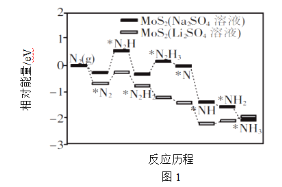
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
(2)2017年Dr.KatsutoshiNagaoka等带领的研究团队开发了一种可以“快速启动的氨制氢工艺”。
已知:NH3(g)=![]() H2(g)+
H2(g)+![]() N2(g) ΔH1=+45.9kJ·mol-1
N2(g) ΔH1=+45.9kJ·mol-1
NH3(g)+![]() O2(g)=
O2(g)=![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH2=-318kJ·mol-1
N2(g) ΔH2=-318kJ·mol-1
则快速制氢反应NH3(g)+![]() O2(g)=H2(g)+
O2(g)=H2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g)的ΔH=___kJ·mol-1。
N2(g)的ΔH=___kJ·mol-1。
(3)氨在高温下分解可以产生氢气和氮气。1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:

表中的t5的值为___。c(NH3)的值从2.28×10-3变化至1.14×10-3的过程中,平均反应速率v(H2)=___ mol·L-1·s-1(保留三位有效数字)。
(4)氨催化氧化时会发生两个竞争反应:
Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
Ⅱ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
为分析某催化剂对反应的选择性,在1L密闭容器中存入1mol氨气和2mol的氧气,测得有关物质的物质的量随温度变化的关系如图2。
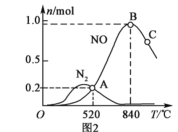
①该催化剂在低温时,选择反应___(填“Ⅰ”或“Ⅱ”)。
②520℃时,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
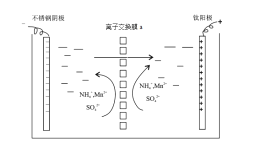
(5)华南理工大学提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图3所示。
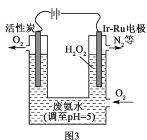
①IrRu惰性电极有吸附O2的作用,该电极上的反应为__。
②理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为__。
【答案】B ﹣75.4 825 7.77×10﹣6 II ![]() O2+2e﹣+2H+=H2O2 1mol
O2+2e﹣+2H+=H2O2 1mol
【解析】
(1)化学反应速率快慢取决于慢反应的速率;
(2)①NH3(g)═![]() H2(g)+
H2(g)+![]() N2(g)△H1=+45.9kJmol﹣1,②NH3(g)+
N2(g)△H1=+45.9kJmol﹣1,②NH3(g)+![]() O2(g)═
O2(g)═![]() H2O(g)+
H2O(g)+![]() N2(g)△H2=﹣318kJmol﹣1,根据盖斯定律可知方程式①×
N2(g)△H2=﹣318kJmol﹣1,根据盖斯定律可知方程式①×![]() +②×
+②×![]() 得方程式NH3(g)+
得方程式NH3(g)+![]() O2(g)═
O2(g)═![]() H2O(g)+
H2O(g)+![]() N2(g)+H2(g)的△H进行相应改变;
N2(g)+H2(g)的△H进行相应改变;
(3)表中NH3分解的半衰期规律:440s、220s、110s、55s、27.5s、…,c(NH3)的值从2.28×10﹣3变化至1.14×10﹣3的过程中,平均反应速率(NH3)=![]() =
=![]() mol/(L·s)=5.18×10﹣6 mol/(L·s),相同时间内v(H2)=
mol/(L·s)=5.18×10﹣6 mol/(L·s),相同时间内v(H2)=![]() v(NH3);
v(NH3);
(4)①根据图象分析,在温度较低时,产生较多的是氮气;
②可逆反应:
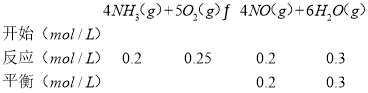
可逆反应:
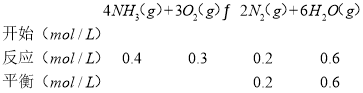
则平衡时c(NH3)=(1﹣0.2﹣0.4)mol/L=0.4mol/L、c(O2)=(2﹣0.25﹣0.3)mol/L=1.45mol/L,c(NO)=c(N2)=0.2mol/L、c(H2O)=(0.3+0.6)mol=0.9mol,反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)的K=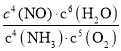 ;
;
(5)①IrRu惰性电极有吸附
②双氧水具有强氧化性,能氧化一水合氨生成氮气,则消耗1mol一水合氨转移3mol电子。
(1)化学反应速率快慢取决于慢反应的速率,能量越高反应速率越慢,根据图知,反应速率取决于*N2→*N2H,*N2→*N2H中能量变低,所以化学反应速率变化明显,故答案为:B;
(2)①NH3(g)═![]() H2(g)+
H2(g)+![]() N2(g)△H1=+45.9kJmol﹣1,②NH3(g)+
N2(g)△H1=+45.9kJmol﹣1,②NH3(g)+![]() O2(g)═
O2(g)═![]() H2O(g)+
H2O(g)+![]() N2(g)△H2=﹣318kJmol﹣1,根据盖斯定律可知方程式①×
N2(g)△H2=﹣318kJmol﹣1,根据盖斯定律可知方程式①×![]() +②×
+②×![]() 得方程式NH3(g)+
得方程式NH3(g)+![]() O2(g)═
O2(g)═![]() H2O(g)+
H2O(g)+![]() N2(g)+H2(g)的△H=(+45.9kJmol﹣1)×
N2(g)+H2(g)的△H=(+45.9kJmol﹣1)×![]() +(﹣318kJmol﹣1)×
+(﹣318kJmol﹣1)×![]() =﹣75.4kJ/mol;
=﹣75.4kJ/mol;
(3)表中NH3分解的半衰期规律:440s、220s、110s、55s、27.5s、…,所以t5=770s+55s=825s;c(NH3)的值从2.28×10﹣3变化至1.14×10﹣3的过程中,平均反应速率(NH3)=![]() =
=![]() mol/(L·s)=5.18×10﹣6 mol/(L·s),相同时间内v(H2)=
mol/(L·s)=5.18×10﹣6 mol/(L·s),相同时间内v(H2)=![]() v(NH3)=
v(NH3)=![]() ×5.18×10﹣6 mol/(L·s)=7.77×10﹣6 mol/(L·s);
×5.18×10﹣6 mol/(L·s)=7.77×10﹣6 mol/(L·s);
(4)①由图可知,该催化剂在高温时,生成的NO物质的量远大于氮气的,故该催化剂在高温下选择反应I,低温时选择反应II,故答案为:II;
②可逆反应:
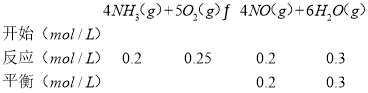
可逆反应:
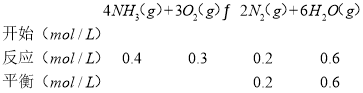
则平衡时c(NH3)=(1﹣0.2﹣0.4)mol/L=0.4mol/Lc(O2)=(2﹣0.25﹣0.3)mol/L=1.45mol/L,c(NO)=c(N2)=0.2mol/L、c(H2O)=(0.3+0.6)mol=0.9mol,此时4NH3(g)+5O2(g)4NO(g)+6H2O(g)的K=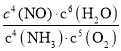 =
=![]() ;
;
(5)①IrRu惰性电极有吸附O2 的作用,该电极上氧气得电子和氢离子反应生成双氧水,电极反应式为O2+2e﹣+2H+=H2O2;
②双氧水具有强氧化性,能氧化一水合氨生成氮气,则消耗1mol一水合氨转移3mol电子,则电路中每转移3 mol 电子,最多可以处理NH3H2O 的物质的量为1mol。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大