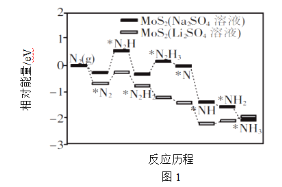
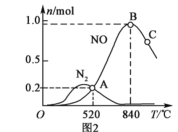
题目内容
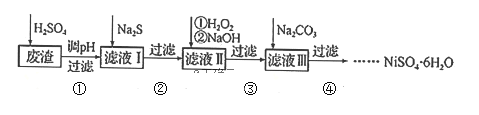
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含有少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
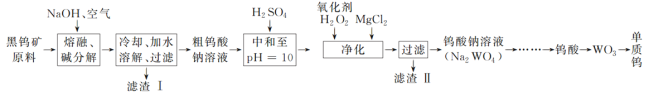
已知:①滤渣Ⅰ的主要成分是Fe2O3、MnO2;②上述流程中,钨的化合价只有在最后一步发生改变;③常温下钨酸溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为______,请写出FeWO4在熔融条件下发生碱分解生成Fe2O3的化学方程式:_____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子含有SiO32—、HAsO32—、HAsO42—等,则“净化”过程中,加入H2O2时发生反应的离子方程式为HAsO32—+H2O2===HAsO42—+H2O,滤渣Ⅱ的主要成分是________。
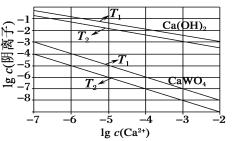
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度的升高而减小。如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则:
①T1_____T2(填“>”或“<”);T1℃时Ksp(CaWO4)=______。
②向钨酸钠溶液中加入石灰乳会得到大量钨酸钙,发生反应的离子方程式为__________。
【答案】+6 4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O HAsO32—+H2O2===HAsO42—+H2O MgSiO3、MgHAsO4 1×10-10 WO42—+Ca(OH)2===CaWO4+2OH-
2Fe2O3+4Na2WO4+4H2O HAsO32—+H2O2===HAsO42—+H2O MgSiO3、MgHAsO4 1×10-10 WO42—+Ca(OH)2===CaWO4+2OH-
【解析】
由黑钨矿冶炼钨的工艺流程:向黑钨矿中(主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物)中加入氧气和氢氧化钠,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和二氧化锰,Si、As生成相应的盐,水浸时,氧化铁和二氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液主要含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2;滤液中钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,HAsO32-被氧化为HAsO42-,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4,过滤,滤渣Ⅱ为:MgSiO3、MgHAsO4,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨,据此分析解答。
(1)由流程图和信息知,钨的化合价只有在最后一步发生改变,WO3中W的化合价为+6,则钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,Fe的化合价为+2,FeWO4在熔融条件下发生碱分解反应,由流程图可知有空气中的氧气和NaOH参加反应,生成Fe2O3、Na2WO4,氧化剂为O2,配平方程式得4FeWO4+8NaOH+O2![]() 2Fe2O3+4Na2WO4+4H2O;
2Fe2O3+4Na2WO4+4H2O;
(2)加入H2O2时阴离子HAsO32-能被氧化为HAsO42-,离子方程式为HAsO32-+H2O2=== HAsO42-+H2O;加入MgCl2生成沉淀,结合溶液中存在的阴离子,滤渣Ⅱ是MgSiO3、MgHAsO4;
(3)①氢氧化钙和钨酸钙的溶解度均随温度升高而减小,Ksp值也随之减小,由图象可知,在阳离子浓度相同时T1 ℃的阴离子浓度大于T2 ℃的阴离子浓度,则T1 ℃对应的Ksp大于T2 ℃对应的Ksp,所以T1<T2;取T1 ℃时的起点,Ksp(CaWO4)=c(Ca2+)×c(WO42)=10-7×10-3=10-10;
②钨酸钠溶液中加入石灰乳,石灰乳微溶,不可拆,离子方程式为WO42+Ca(OH)2===CaWO4+2OH-。

 学习实践园地系列答案
学习实践园地系列答案【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | A | B | C | D |
气体 | CO2 | Cl2 | NH3 | NO |
a | 盐酸 | 浓盐酸 | 饱和NH4Cl溶液 | 稀硝酸 |
b | CaCO3 | MnO2 | 消石灰 | 铜屑 |
c | 饱和Na2CO3溶液 | NaOH溶液 | H2O | H2O |
d | 浓硫酸 | 浓硫酸 | 固体NaOH | 浓硫酸 |
A.AB.BC.CD.D