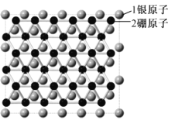
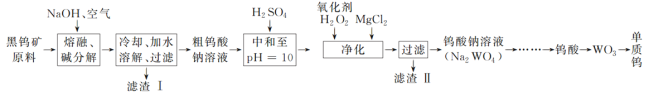
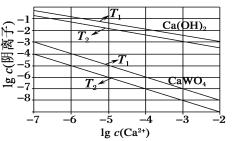
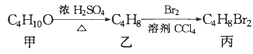题目内容
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
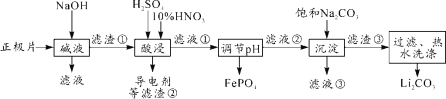
(1)从“正极”可以回收的金属有___________。
(2)“碱溶”时Al箔溶解的离子方程式_________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为______mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO32-)=________ mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
① 实验中加入HgCl2饱和溶液的目的是__________。
② 磷酸亚铁锂电池中铁的含量为_______。
【答案】Li、Fe、Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ 0.3 4 阴极 Li1-xFePO4+xLi++xe-=LiFePO4 将溶液中过量Sn2+转化为稳定的SnCl62-,防止其干扰Fe2+的测定 28.8%
【解析】
(1)根据分析流程,碱溶可得到NaAlO2滤液,调节pH值,生成的沉淀为FePO4,加入碳酸钠,可生成Li2CO3沉淀,因此从“正极”可以回收的金属有Li、Fe、Al,故答案为:Li、Fe、Al;
(2)碱溶时Al箔与氢氧化钠反应,溶解的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时HNO3转化为NO,产生标准状况下2.24LNO的物质的量为![]() =0.1mol,产生1molNO,转移3mol电子,则生成0.1molNO转移0.3mol电子,LiFePO4与硝酸反应转化为FePO4,Fe的化合价由+2价变为+3价,溶解1mol LiFePO4转移1mol电子,则转移0.3mol电子,溶解0.3mol LiFePO4,故答案为:0.3;
=0.1mol,产生1molNO,转移3mol电子,则生成0.1molNO转移0.3mol电子,LiFePO4与硝酸反应转化为FePO4,Fe的化合价由+2价变为+3价,溶解1mol LiFePO4转移1mol电子,则转移0.3mol电子,溶解0.3mol LiFePO4,故答案为:0.3;
(4)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到99%,混合后溶液中含有的c(Li+)=![]() ,已知:Ksp(Li2CO3)=c2(Li+)·c(CO32-)=1.6×10-3,则滤液③中c(CO32-)=
,已知:Ksp(Li2CO3)=c2(Li+)·c(CO32-)=1.6×10-3,则滤液③中c(CO32-)=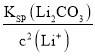 =
=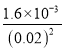 =4 mol/L,故答案为:4;
=4 mol/L,故答案为:4;
(5)充电时,阳离子Li+移向阴极;放电时,正极发生还原反应,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4,故答案为:阴极;Li1-xFePO4+xLi++xe-=LiFePO4;
(6)①实验中加入HgCl2饱和溶液,可以发生反应:4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2,这样就可以使溶液中过量的Sn2+转化为稳定的络离子SnCl62-,从而防止用重铬酸钾溶液滴定溶液中Fe2+时干扰实验结果的测定,造成实验误差,故答案为:将溶液中过量Sn2+转化为稳定的SnCl62-,防止其干扰Fe2+的测定;
②根据6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可知n(Fe2+)=6n(Cr2O72-)=![]() ,m(Fe)=
,m(Fe)=![]() ,所以铁的百分含量=
,所以铁的百分含量=  。
。

【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
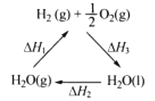
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
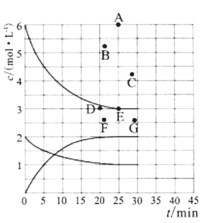
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。