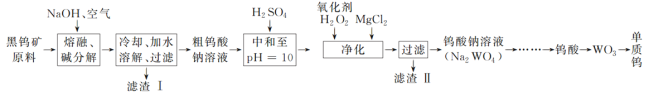
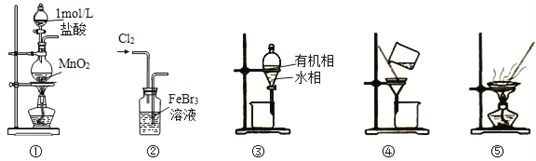
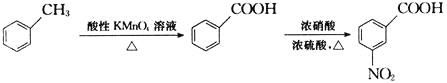
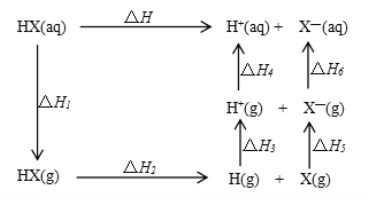
题目内容
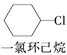
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/LCH3COOH溶液中逐滴加入 KOH溶液,其pH变化曲线如图(1)所示(忽略温度变化)。请回答下列有关问题:
(1)![]() 点溶液中c(H+)约为______________。
点溶液中c(H+)约为______________。
(2)![]() 、c、d三点中水的电离程度最大的是_________。
、c、d三点中水的电离程度最大的是_________。
(3)若学习小组在该温度下用此醋酸滴定某未知浓度的KOH溶液:
①滴定过程中宜选用____________作指示剂;滴定达到终点的现象是_________________。
②下列操作会造成结果偏高的是_________。
A.酸式滴定管水洗后直接装入醋酸 B.锥形瓶水洗后未干燥
C.滴定终点时俯视酸式滴定管的读数D.部分酸滴到锥形瓶外面
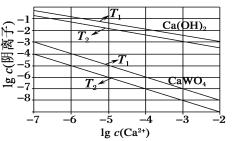
③若滴定开始和结束时,酸式滴定管中的液面如图(2)所示,则所用醋酸的体积为_______mL。
(4)常温下,若向20 mL的稀氨水中逐滴加入等物质的量浓度的盐酸,下列变化趋势正确的是____(填序号)。
【答案】4×10-4 mol/L c点 酚酞 最后一滴醋酸溶液滴入时,溶液由浅红色变为无色,且30s内不恢复 AD 20.30 B
【解析】
(1)0.01 mol/L的醋酸溶液中c(H+)≈c(CH3COO-),c(CH3COOH)≈0.01mol/L,根据平衡常数的定义式计算该溶液中c(H+);
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)越大、碱中c(OH-)越大其抑制水电离程度越大;
(3)①强碱滴定弱酸,终点时溶液呈碱性,应该选取碱性范围内变色的酚酞作指示剂;根据溶液在滴定终点的颜色变化判断滴定终点;
②A. 酸式滴定管水洗后直接装入醋酸,导致醋酸浓度减小,消耗的醋酸体积偏大;
B. 锥形瓶水洗后未干燥,不影响消耗醋酸体积;
C. 滴定终点时俯视酸式滴定管的读数,导致醋酸体积偏小;
D. 部分酸滴到锥形瓶外面,导致消耗醋酸体积偏大;
③滴定前读数为0.80 mL,滴定后读数为21.10 mL;
(4)常温下,若向20 mL的稀氨水中逐滴加入等物质的量浓度的盐酸,未加稀盐酸时,溶液为碱性溶液,溶液的pH>7,加入稀盐酸20 mL时,二者恰好完全反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性,溶液的pH<7,溶液呈中性时,稀盐酸体积小于20 mL。
(1)0.01 mol/L的醋酸溶液中c(H+)≈c(CH3COO-),c(CH3COOH)≈0.01 mol/L,由于K=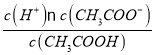 =1.6×10-5,所以该溶液中c(H+)=
=1.6×10-5,所以该溶液中c(H+)=![]() =
=![]() mol/L=4×10-4mol/L;
mol/L=4×10-4mol/L;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)越大、碱中c(OH-)越大其抑制水电离程度越大,a点溶液是酸溶液而抑制水电离、c点溶液为醋酸钠溶液而促进水电离、d点为NaOH和醋酸钠混合溶液,NaOH会抑制水电离,则水电离程度最大的是c点;
(3)①强碱滴定弱酸,终点时溶液呈碱性,应该选取酚酞作指示剂;
用醋酸滴定NaOH溶液,以酚酞为指示剂,开始时溶液颜色为红色,随着醋酸的滴加,溶液的碱性逐渐减弱,红色逐渐变浅,当滴定达到终点的现象是最后一滴醋酸溶液滴入时,溶液由浅红色变为无色,且30s内不恢复;
②A. 酸式滴定管水洗后直接装入醋酸,导致醋酸浓度减小,等物质的量的NaOH溶液消耗的醋酸体积偏大,导致测定溶液浓度偏高,A符合题意;
B. 锥形瓶水洗后未干燥,不影响消耗醋酸体积,则测定溶液浓度无影响,B不符合题意;
C. 滴定终点时俯视酸式滴定管的读数,使醋酸体积偏小,导致测定溶液浓度偏低,C不符合题意;
D. 部分酸滴到锥形瓶外面,使消耗醋酸体积偏大,导致测定溶液浓度偏高,D符合题意;
故合理选项是AD;
③滴定前读数为0.80 mL,滴定后读数为21.10 mL,则消耗溶液体积V=(21.10-0.80) mL=20.30 mL;
(4)常温下,若向20 mL的稀氨水中逐滴加入等物质的量浓度的盐酸,未加稀盐酸时,溶液为碱性溶液,溶液的pH>7,加入稀盐酸20 mL时,二者恰好完全反应生成NH4Cl,NH4Cl是强酸弱碱盐,水解使水溶液呈酸性,溶液的pH<7,因此当溶液呈中性时,稀盐酸体积小于20 mL,符合条件的为B。

 阅读快车系列答案
阅读快车系列答案