题目内容
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
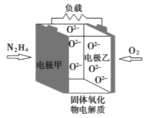
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
【答案】C
【解析】
该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+2O2--4e-=N2↑+2H2O,故电极甲作负极,电极乙作正极,正极上氧气得电子发生还原反应,电极反应式为:O2+4e-=2O2-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电子的方向分析解答。
A. 放电时,阴离子向负极移动,即O2由电极乙移向电极甲,A项错误;
B. 反应生成物均为无毒无害的物质,负极上反应生成氮气,则电池总反应为N2H4+O2=N2↑+2H2O,B项错误;
C. 由电池总反应为N2H4+O2=N2↑+2H2O可知,当甲电极上有1molN2H4消耗时,乙电极上有1molO2被还原,所以标况下乙电极上有22.4LO2参与反应,C项正确;
D. 电池外电路的电子从电源的负极流向正极,即由电极甲移向电极乙,D项错误;
答案选C。

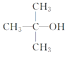
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
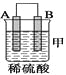
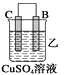
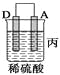
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。