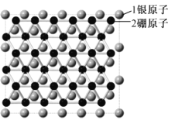
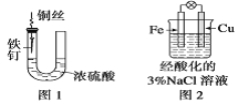
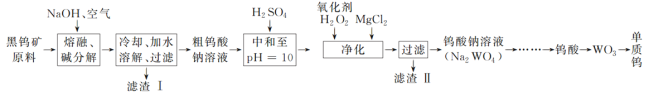
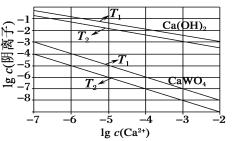
题目内容
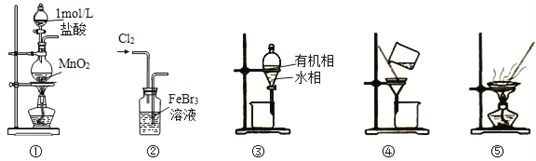
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | A | B | C | D |
气体 | CO2 | Cl2 | NH3 | NO |
a | 盐酸 | 浓盐酸 | 饱和NH4Cl溶液 | 稀硝酸 |
b | CaCO3 | MnO2 | 消石灰 | 铜屑 |
c | 饱和Na2CO3溶液 | NaOH溶液 | H2O | H2O |
d | 浓硫酸 | 浓硫酸 | 固体NaOH | 浓硫酸 |
A.AB.BC.CD.D
【答案】D
【解析】
A. 盐酸和CaCO3反应制得的CO2中含有杂质HCl、水蒸气,应用饱和NaHCO3溶液除去HCl,故A错误;
B. 浓盐酸和MnO2加热反应制得的Cl2中含有杂质HCl、水蒸气,除去HCl应用饱和食盐水,故B错误;
C. NH3极易溶于水,通过盛有水的洗气瓶,NH3会被吸收,故C错误;
D. 稀硝酸和铜屑反应制得的NO难溶于水且不与水反应,NO被空气氧化成的NO2与水反应又可生成NO,故将生成的气体依次通过水、浓硫酸,可以得到纯净、干燥的NO,故D正确;
故答案为D。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
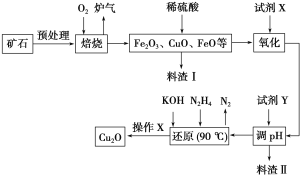
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
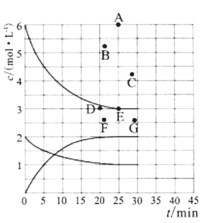
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。