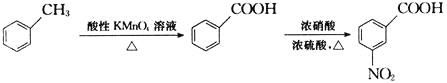
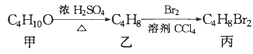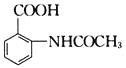题目内容
【题目】固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
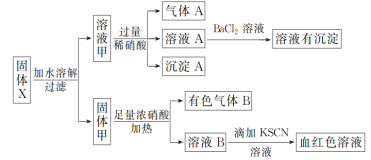
根据上述实验,以下说法正确的是( )
A.气体A一定只是NO
B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3
C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3
D.溶液甲中一定含有K2SiO3,可能含有KAlO2、MgCl2
【答案】B
【解析】
固体粉末X中Fe、Fe2O3不溶于水,则固体甲可能为Fe、Fe2O3,加入浓硝酸,产生有色气体二氧化氮,则一定含有Fe,得到的溶液B中含有硝酸铁,遇到硫氰化钾显示血红色;K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3能溶于水,向其中过量的稀硝酸,硅酸钾和起反应得到硅酸沉淀,则原物质中一定含有K2SiO3,则一定不含有MgCl2;亚硫酸钾被氧化为硫酸钾,可以产生NO气体;KAlO2与稀硝酸反应,先出沉淀随后溶解;K2CO3可以和稀硝酸反应生成二氧化碳气体;溶液A中加入氯化钡,产生沉淀,稀硝酸过量,则原物质中一定含有K2SO3,则气体A可能是NO或CO2和NO二者都有,可能含有KAlO2、K2CO3,一定不含有MgCl2,以此来解答。
A. 根据分析可知气体A可能是NO或CO2和NO二者都有,故A错误;
B. 溶液A中加入BaCl2溶液有沉淀产生,说明溶液A中含有SO42,则溶液甲中必含有K2SO3,当甲与稀硝酸反应时SO32被氧化为SO42,故B正确;
C. 当固体粉末X中含有足量的Fe时,Fe3+可以被还原为Fe2+,加入KSCN溶液时,不会出现血红色,故C错误;
D. 溶液甲中加过量稀硝酸,生成沉淀A,说明溶液甲中一定含有K2SiO3,由于Mg2+与SiO32不能共存,所以溶液甲中一定没有MgCl2,故D错误;
故答案为B。

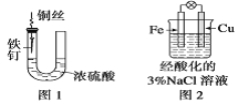
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c