题目内容
4.某元素的一个原子形成的离子可表示为${\;}_{a}^{b}$Xn-,下列说法正确的是( )| A. | ${\;}_{a}^{b}$Xn-含有的中子数为a+b | |
| B. | ${\;}_{a}^{b}$Xn-含有的电子数为a-n | |
| C. | X原子的质量数为a+b+n | |
| D. | 一个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$ g |
分析 根据abXn-中质子数是a,质量数是b,中子数=质量数-质子数,阴离子中核外电子数=核内质子数+电荷数,原子的质量为原子的相对原子质量和阿伏伽德罗常数的比值.
解答 解:A、该微粒中中子数=质量数-质子数=b-a,故A错误;
B、该微粒的核外电子数=核内质子数+电荷数=a+n,故B错误;
C、该微粒的质量数为b,故C错误;
D、原子的质量为原子的相对原子质量和阿伏伽德罗常数的比值,即$\frac{b}{6.02×1{0}^{23}}$g,故D正确;
故选D.
点评 本题考查了质子数、质量数和中子数之间的关系,难度不大,明确阴阳离子核外电子数的计算方法.

练习册系列答案
相关题目
14.下列选项中,都是只由极性键形成的非极性分子的一组物质是( )
| A. | BCl3、CS2、SO3 | B. | CH4、CH2Cl2、BeCl2 | ||
| C. | P4、SiO2、CO2 | D. | NF3、CCl4、苯(C6H6) |
15.提纯下列物质(括号内为杂质),选用的除杂试剂与分离方法正确的是( )
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.一定量的镁铝合金与375mL2mol/L的HNO3完全反应生成3.36LNO(标准状态)和镁盐、铝盐等,再向反应后的溶液中加入3mol/LNaOH溶液,使镁、铝元素完全沉淀下来,则所加入氢氧化钠溶液的体积是( )
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
19.已知C(s)+CO2(g)?2CO(g)正反应方向是吸热过程,下列可使正反应速率增大的措施是( )
①减小容器体积使增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥降低温度.
①减小容器体积使增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥降低温度.
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①③⑥ |
9.对下列化学反应的热现象的说法正确的是( )
| A. | 所有的放热反应不加热都能进行 | |
| B. | 任何化学反应的发生一定伴有能量变化 | |
| C. | 吸热反应和放热反应都需要加热才能发生 | |
| D. | 化学反应吸收或放出热量的多少与参加反应的物质的多少无关 |
16.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
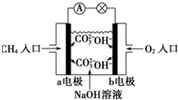

| A. | a极是负极,发生氧化反应 | |
| B. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| C. | 该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O | |
| D. | 甲烷燃料电池是环保电池 |
13.氨分子空间构型是三角锥形,键角小于109°28′,而甲烷是正四面体,键角等于109°28′,键角差别是因为( )
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强 | |
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
14.已知酸性: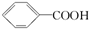 >H2CO3>
>H2CO3>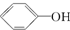 ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 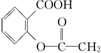 转变为
转变为 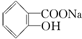 的最佳方法是( )
的最佳方法是( )
 >H2CO3>
>H2CO3> ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为  的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与足量的NaOH溶液共热后,再加入适量H2SO4 |