题目内容
16.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )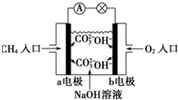
| A. | a极是负极,发生氧化反应 | |
| B. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| C. | 该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O | |
| D. | 甲烷燃料电池是环保电池 |
分析 燃料电池中,燃料做负极发生氧化反应,氧气作正极发生还原反应,电流由正极流向负极,甲烷燃料电池的总反应即为燃烧反应,据此分析.
解答 解:A、燃料电池中,燃料氢气做负极,即a是负极发生氧化反应,故A正确;
B、在碱性电解质环境下,正极的电极反应式是:O2+2H2O+4e-=4OH-,故B正确;
C、甲烷燃料电池的总反应即为燃烧反应,但由于为碱性电解质,所以总反应为CH4+2OH-+2O2=CO32-+3H2O,故C错误;
D、氢氧燃料电池的产物是水,不会产生污染,是环保电池,故D正确.
故选C.
点评 本题考查学生燃料电池的工作原理知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
6.下列实验操作、现象、和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
7.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H1;12H2(g)+12Cl2(g)═HCl(g)△H2 | |
| D. | CO(g)+12O2(g)═CO2(g)△H1;2CO(g)+O2(g)═2CO2(g)△H2 |
4.某元素的一个原子形成的离子可表示为baXn-,下列说法正确的是( )
| A. | baXn-含有的中子数为a+b | |
| B. | baXn-含有的电子数为a-n | |
| C. | X原子的质量数为a+b+n | |
| D. | 一个X原子的质量约为b6.02×1023 g |
11.原电池产生电流的本质原因是( )
| A. | 原电池中电解质溶液能电离出自由移动的离子 | |
| B. | 有两根导线将两个活动性不同的电极连接 | |
| C. | 电极上进行的氧化还原反应的生成物为电子 | |
| D. | 电极上进行氧化还原反应时有电子的定向移动 |
1.下列说法不正确的是( )
| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
8.在容积一定的密闭容器中,反应2A?B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
| A. | 正反应是吸热反应,且A是气态 | |
| B. | 正反应是放热反应,且A不是气态 | |
| C. | 其他条件不变,加入少量A,该平衡不移动 | |
| D. | 改变压强对该平衡的移动无影响 |
5.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| B. | IA族与ⅦA族元素间可形成离子键也可形成共价键 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |

 .
. .
.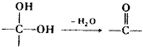 ②
② 中氯原子较难水解物质A(
中氯原子较难水解物质A( )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 +2Cl2
+2Cl2
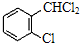 +2HCl、
+2HCl、 +2NaOH
+2NaOH
 +2NaCl+2H2O.
+2NaCl+2H2O. 和
和 .
. ,两个取代基分别在间位和对位,共3种
,两个取代基分别在间位和对位,共3种
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH