题目内容
12.一定量的镁铝合金与375mL2mol/L的HNO3完全反应生成3.36LNO(标准状态)和镁盐、铝盐等,再向反应后的溶液中加入3mol/LNaOH溶液,使镁、铝元素完全沉淀下来,则所加入氢氧化钠溶液的体积是( )| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
分析 硝酸的物质的量为:0.375L×2mol/L=0.75mol,生成NO的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,根据质量守恒以及反应后溶液成分为NaNO3进行计算.
解答 解:硝酸的物质的量为:0.375L×2mol/L=0.75mol,生成NO的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,
所以反应后溶液中NO3-离子的物质的量为:0.75mol-0.15mol=0.6mol,
再向反应后的溶液中加入 3mol/L的NaOH 溶液,使铝镁元素恰好全部转化为沉淀,
则反应后溶液的成分为NaNO3,由质量守恒可知,n(NaOH)=n(NaNO3)=n(NO3-)=0.6mol,
则所加 NaOH 溶液的体积是V=$\frac{0.6mol}{3mol/L}$=0.2L=200mL,
故选B.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,注意从质量守恒的角度解答该题,明确反应后溶质组成为解答关键.

练习册系列答案
相关题目
2.下列各组元素中原子序数按由大到小的顺序排列的是( )
| A. | Be.C.B | B. | Li.O.Cl | C. | S.Si.Al | D. | C.S.Mg |
3.下列各项判断正确的是( )
| A. | AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.该反应中,每生成1 mol AlN需转移1.5 mol电子 | |
| B. | CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,则在CsICl2溶液中通入Cl2,有单质碘生成 | |
| C. | 反应A+3B═2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol/(L•s);②v(B)=0.6 mol/(L•s);③v(C)=0.4 mol/(L•s);④v(D)=0.45 mol/(L•s).该反应进行的快慢顺序为④>③=②>① | |
| D. | AlCl3溶液中加入过量稀氨水,则反应的离子方程式为:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
7.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1;2CO(g)+O2(g)═2CO2(g)△H2 |
17.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.(4)有两种化合物均由①、④、⑤、⑧四种元素形成,两者之间可以相互发生化学反应,其离子反应方程式为:HSO3-+H+=H2O+SO2↑.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
4.某元素的一个原子形成的离子可表示为${\;}_{a}^{b}$Xn-,下列说法正确的是( )
| A. | ${\;}_{a}^{b}$Xn-含有的中子数为a+b | |
| B. | ${\;}_{a}^{b}$Xn-含有的电子数为a-n | |
| C. | X原子的质量数为a+b+n | |
| D. | 一个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$ g |
1.下列说法不正确的是( )
| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
2.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )

| A. | 离子半径:X>Y>Z | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
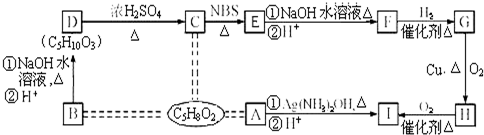
 ③
③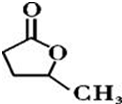 、
、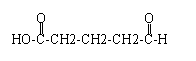 .
.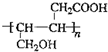 .
.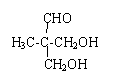 .
.