题目内容
15.提纯下列物质(括号内为杂质),选用的除杂试剂与分离方法正确的是( )| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙酸与碳酸钠反应,反应后与乙酸乙酯分层;
B.乙烯被高锰酸钾氧化生成二氧化碳;
C.溴与KOH反应后与苯分层;
D.苯酚与溴水反应,且溴易溶于苯.
解答 解:A.乙酸与碳酸钠反应,反应后与乙酸乙酯分层,则分离方法应为分液,故A错误;
B.乙烯被高锰酸钾氧化生成二氧化碳,则除杂后会引入新的杂质,不符合除杂原则,故B错误;
C.溴与KOH反应后与苯分层,分离方法为分液,故C正确;
D.苯酚与溴水反应,且溴易溶于苯,则除杂后会引入新的杂质,不符合除杂原则,故D错误;
故选C.
点评 本题考查物质的分离、提纯,为高频考点,侧重物质除杂的考查,把握物质的性质及除杂的原则为解答的关键,选项D为解答的易错点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列各项叙述中,正确的是( )
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为纺锤形,能量也相等 | |
| D. | 氮原子的最外层电子的轨道表示式: |
6.下列实验操作、现象、和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
3.下列各项判断正确的是( )
| A. | AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.该反应中,每生成1 mol AlN需转移1.5 mol电子 | |
| B. | CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,则在CsICl2溶液中通入Cl2,有单质碘生成 | |
| C. | 反应A+3B═2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol/(L•s);②v(B)=0.6 mol/(L•s);③v(C)=0.4 mol/(L•s);④v(D)=0.45 mol/(L•s).该反应进行的快慢顺序为④>③=②>① | |
| D. | AlCl3溶液中加入过量稀氨水,则反应的离子方程式为:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
7.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1;2CO(g)+O2(g)═2CO2(g)△H2 |
4.某元素的一个原子形成的离子可表示为${\;}_{a}^{b}$Xn-,下列说法正确的是( )
| A. | ${\;}_{a}^{b}$Xn-含有的中子数为a+b | |
| B. | ${\;}_{a}^{b}$Xn-含有的电子数为a-n | |
| C. | X原子的质量数为a+b+n | |
| D. | 一个X原子的质量约为$\frac{b}{6.02×1{0}^{23}}$ g |
5.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| B. | IA族与ⅦA族元素间可形成离子键也可形成共价键 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |

 ③
③ 、
、 .
. .
.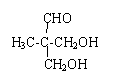 .
.