题目内容
20.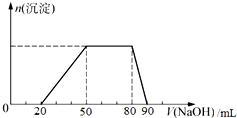 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
分析 探究一:开始加入20mLNaOH无沉淀生成说明发生的反应是:H++OH-═H2O,则溶液中含有H+,所以不含有CO32-、AlO2-;再加入氢氧化钠溶液至50mL,由图象分析可知生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,则溶液中含有Al3+;继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-?NH3•H2O,则溶液中含有NH4+;消继续加入氢氧化钠溶液,沉淀开始溶解,到加入90mL氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠10mL,则溶液中不含有Ag+、Mg2+、Fe3+,在酸性条件下NO3-能氧化碘离子,所以不能含有NO3-;
探究二:还原性:I->Br-,加入氯气5.6L时溶液中I-amol,则说明通入5.6L Cl2只发生:Cl2+2I-═I2+2Cl-,5.6L变成11.2L,消耗5.6L Cl2的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,根据反应方程式计算.
解答 解:探究一:开始加入20mLNaOH无沉淀生成说明发生的反应是:H++OH-═H2O,则溶液中含有H+,所以不含有CO32-、AlO2-;再加入氢氧化钠溶液至50mL,由图象分析可知生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,则溶液中含有Al3+;继续加入氢氧化钠,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-?NH3•H2O,则溶液中含有NH4+;消继续加入氢氧化钠溶液,沉淀开始溶解,到加入90mL氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠10mL,则溶液中不含有Ag+、Mg2+、Fe3+,不能确定是否含有NO3-;
探究二:还原性:I->Br-,加入氯气5.6L时溶液中I-amol,则说明通入5.6L Cl2只发生:Cl2+2I-═I2+2Cl-,5.6L变成11.2L,消耗5.6L Cl2的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,
A.5.6L变成11.2L,消耗Cl2的物质的量为0.25mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,Br-减少0.2mol,则Br-与反应的氯气为0.1mol,所以与反应的氯气为0.15mol,则I-的物质的量为0.3mol,即X=0.3,故A正确;
B.根据表数据:5.6L变成11.2L,消耗Cl2的物质的量为0.25mol,发生:Cl2 +2Br-═Br2+2Cl-,Cl2+2I-═I2+2Cl-,Br-减少0.2mol,则Br-与反应的氯气为0.1mol,所以与反应的氯气为0.15mol,则I-的物质的量为0.3mol,所以原溶液中:n(I-)=0.5mol+0.3mol=0.8mol,n(Cl-)=2.5mol-0.5mol=2mol,
n(Cl-):n(Br-):n(I-)=2:3:0.8=10:15:4,故B正确;
C.图象中只有氢氧化钠的体积一种数据无法计算氢氧化钠的浓度,故C错误;
D.溶液中一定含有的离子为Cl-、Br-、I-、H+、Al3+、NH4+,所以溶液中大量存在的离子共六种,故D正确.
故选C.
点评 本题考查离子的判断和计算,图标数据分析的方法和反应实质,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | Fe3+>Cu2+>Fe2+ | B. | Cu2+>Fe3+>Fe2+ | C. | Fe3+>Fe2+>Cu2+ | D. | Fe2+>Cu2+>Fe3+ |
| A. | 1mol乙烯与Cl2完全加成,然后再与Cl2完全取代,共需5mol Cl2 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
| A. | 在稀硫酸溶液中滴加少量硫酸铜溶液 | |
| B. | 不用稀硫酸,改用98%的浓硫酸 | |
| C. | 不用1 mol/L稀硫酸,改用2 mol/L硫酸 | |
| D. | 不用铁片,改用铁粉 |
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应. 的H202,请与出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O
的H202,请与出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O