题目内容
12.有如下两个反应:(1)Cu+2Fe3+=Cu2++2Fe2+;(2)Fe+Cu2+=Fe2++Cu.判断Fe3+、Fe2+、Cu2+氧化性强弱顺序排列正确的是( )| A. | Fe3+>Cu2+>Fe2+ | B. | Cu2+>Fe3+>Fe2+ | C. | Fe3+>Fe2+>Cu2+ | D. | Fe2+>Cu2+>Fe3+ |
分析 相同条件下,同一反应中氧化剂的氧化性大于氧化产物的氧化性,据此分析.
解答 解:2Fe3++Cu═2Fe2++Cu2+,氧化性是Fe3+>Cu2+;
Fe+Cu2+=Fe2++Cu,氧化性是Cu2+>Fe2+;
则氧化性顺序是:Fe3+>Cu2+>Fe2+,
故选A.
点评 本题考查学生分析和解决问题的能力,可以根据氧化剂的氧化性强于氧化产物的氧化性行回答,题目难度不大.

练习册系列答案
相关题目
3.下列物质:(1)Na(2)石墨(3)Na2O (4)SO2 (5)CO2 (6)SO3 (7)NH3•H2O (8)H2S (9)HCl (10)H2SO4 (11)Ba(OH)2 (12)熔融的NaCl (13)蔗糖 (14)NaCl溶液.属于电解质的有
( )
( )
| A. | (3)(7)(9)(10)(11)(12) | B. | (3)(7)(9)(10)(11)(14) | C. | (3)(7)(8)(9)(10)(11)(12) | D. | (1)(3)(7)(8)(9)(10)(11)(12) |
20. 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
为探究其成分,进行了以下实验:
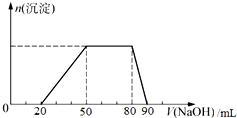
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
下列说法中错误的是( )
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
7.短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )


| A. | Z一定是活泼的金属 | |
| B. | Y的最高价氧化物的水化物是一种强酸 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质跟足量水反应时,有3 mol电子发生转移 |
17.在水溶液中能电离出大量Al3+的电解质是( )
| A. | NaAlO2 | B. | KAl(SO4)2•12H2O | C. | Al(OH)3 | D. | Al2O3 |
4.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评 价 |
| A | NaHSO4溶液与Ba(OH)2溶液反应至 SO42-沉淀完全: 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | 正 确 |
| B | 向碳酸镁溶液中加入足量稀盐酸: CO32-+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O=Fe(OH)3↓+3H+ | 正 确 |
| D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. | 1molFe与足量盐酸反应,转移的电子总数为1.806×1024个 | |
| B. | 常温常压下,1 mol羟基(-OH)所含电子数为6.02×1024个 | |
| C. | 常温常压下,34g H2O2中含有共用电子对数为1.806×1024个 | |
| D. | 58.5gNaCl晶体中离子总数为6.02×1023个 |