题目内容
10.用铁与稀硫酸反应制取氢气时,下列不能使氢气生成速率加大的是( )| A. | 在稀硫酸溶液中滴加少量硫酸铜溶液 | |
| B. | 不用稀硫酸,改用98%的浓硫酸 | |
| C. | 不用1 mol/L稀硫酸,改用2 mol/L硫酸 | |
| D. | 不用铁片,改用铁粉 |
分析 加快生成氢气的速率,可增大浓度,升高温度,增大固体的表面积以及形成原电池反应,以此解答.
解答 解:A.滴加少量CuSO4溶液,铁置换出铜,形成铜铁原电池,反应速率增大,故A不选;
B.浓硫酸与铁反应生成二氧化硫而不生成氢气,或发生钝化,故B选;
C.硫酸浓度增大,可增大反应速率,故C不选;
D.D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.
故选B.
点评 本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
20.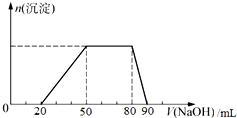 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
下列说法中错误的是( )
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
1.下列说法正确的是( )
| A. | 1molFe与足量盐酸反应,转移的电子总数为1.806×1024个 | |
| B. | 常温常压下,1 mol羟基(-OH)所含电子数为6.02×1024个 | |
| C. | 常温常压下,34g H2O2中含有共用电子对数为1.806×1024个 | |
| D. | 58.5gNaCl晶体中离子总数为6.02×1023个 |
18.RO3n-中共有x个电子,R原子的质量数为A,则a克RO3n-中含有质子的物质的量为( )
| A. | $\frac{a}{A+48}$(x-n)mol | B. | $\frac{a}{A+48}$(x-24-n)mol | C. | $\frac{a}{A+48}$(x+n)mol | D. | (x-n)mol |
19.下列物质的保存方法不正确的是( )
| A. | 钠保存在细口瓶中,并加煤油液封 | |
| B. | 氯水保存在棕色瓶中,并置于冷暗处 | |
| C. | Na2CO3溶液保存在无色瓶中,塞橡皮塞 | |
| D. | 工业上将Cl2贮存在钢瓶中 |