题目内容
17.草酸(H2C2O4,其中H的化合价为+1,O的化合价为-2)能使高锰酸钾溶液褪色,其反应的离子方程式为:2H2C2O4+5MnO4-+6H+--2Mn2++10CO2↑+8H2O
①补充并配平上述方程式;
②该反应中的氧化剂是MnO4-,氧化产物是CO2.
③若消耗18g H2C2O4,则该反应转移的电子数目为0.4NA,生成的CO2气体通入到足量的澄清石灰水中,产生的白色沉淀的质量为40g.
分析 (1)反应中Mn元素的化合价降低了5价,C元素的化合价升高了2价,根据电子守恒结合元素守恒来配平方程式;
(2)化合价降低元素所在的反应物是氧化剂,化合价升高原元素所在的产物是氧化产物;
(3)根据化学方程式结合电子转移情况进行计算即可.
解答 解:反应中Mn元素的化合价降低了5价,C元素的化合价升高了2价,根据电子守恒,Mn元素的前边系数是2,草酸前边系数是1,二氧化碳前边系数是10,草酸根据元素守恒电荷守恒,得到:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2;5;6H+;2;10;8;
(2)化合价降低元素所在的反应物MnO4-是氧化剂,化合价升高原元素所在的产物CO2是氧化产物,故答案为:MnO4-;CO2.
(3)反应2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O转移电子是10mol,消耗5mol即450gH2C2O4,若消耗18gH2C2O4,则该反应转移的电子为:0.4mol,数目为0.4NA,产生二氧化碳0.4mol通入到足量的澄清石灰水中,产生的白色沉淀0.4mol,质量为40g,故答案为:0.4NA;40.
点评 本题考查学生氧化还原反应的电子守恒来配平方程式的方法以及有关概念的理解和判断、化学方程式的计算等知识,属于综合知识的考查,难度不大.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
7.某同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 所用NaOH已经潮解 | |
| B. | 向容量瓶中加水定容时俯视标线 | |
| C. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| D. | 定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水 |
8.工业刻制印刷电路的主要原理为:Cu+2FeCl3=2FeCl2+CuCl2.有关该反应的说法正确的是( )
| A. | Cu是氧化剂 | B. | FeCl3是还原剂 | ||
| C. | Cu在反应中失去电子 | D. | FeCl3发生氧化反应 |
12.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中Cl-、NO3-、Na+、SO32- | B. | 在碱性溶液中CO32-、K+、SO42-、Br- | ||
| C. | Na2S溶液中SO42-、K+、Cl-、Cu2+ | D. | pH=12的溶液中NO3-、I-、Na+、Al3+ |
2.下列化学反应的离子方程式正确的是( )
| A. | 将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 将铝片加入盐酸溶液中:2Al+6H+=2Al3++3H2↑ | |
| C. | 向碳酸钠溶液中加入CH3COOH:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-=CaCO3↓+H2O |
20.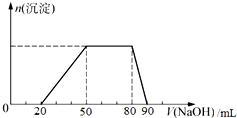 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
下列说法中错误的是( )
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |