题目内容
11. 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.(I)若某可逆反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$写出该反应的化学方程式C(s)+H2O(g)?CO(g)+H2 (g);.
(Ⅱ)若该密闭容器中加人的是2molFe(a)与1molH2O(g).发生3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0,t1秒时,H2的物质的量为0.20mol,到第t2称时恰好达到平衡.此时H2的物质的量为0.35mol.
(1)t1-t2这段时间内的化学反应速率v(H2)$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1.
(2)若继续加人2molFe(s),则平衡不移动(填“向正反应方向”、“向逆反应方向”或“不”).再继续通人1mol H2O(g).达到平衡后.H2物质的量为0.7mol.
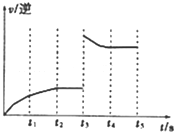
(3)该反应的逆反应速率随时间变化的关系如图.t3时改变了某种条件.改变的条件是升高了温度或增大了H2的浓度.
分析 (Ⅰ)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比,由碳元素守恒可知,反应物中有固体碳;
(Ⅱ)(1)根据v=$\frac{△c}{△t}$计算v(H2);
(2)Fe是固体,加入Fe后,平衡不移动;再继续通入1mol H2O(g),等效为开始通入2mol H2O(g),等效为在原平衡基础上增大压强,平衡不移动,水蒸汽转化率不变;
(3)如右图t3时刻,逆反应反应速率突然增大,而后逆反应速率减小,反应向逆反应进行.
解答 解:(Ⅰ)(Ⅰ)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比,由碳元素守恒可知,反应物中有固体碳,所以方程式为:C(s)+H2O(g)?CO(g)+H2 (g),
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(Ⅱ)(1)v(H2)=$\frac{\frac{0.35mol-0.2mol}{5L}}{({t}_{2}-{t}_{1})s}$=$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1,
故答案为:$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1;
(2)Fe是固体,加入Fe后,平衡不移动;再继续通入1mol H2O(g),等效为开始通入2mol H2O(g),等效为在原平衡基础上增大压强,平衡不移动,水蒸汽转化率不变,达到平衡后H2物质的量为2×0.35mol=0.7mol,
故答案为:不;0.7;
(3)如右图t3时刻,逆反应反应速率突然增大,而后逆反应速率减小,反应向逆反应进行,可能是增大氢气浓度,正反应为放热反应,也可能是升高温度,
故答案为:升高了温度或增大了H2的浓度.
点评 本题考查化学平衡计算及影响因素、反应速率计算、平衡常数等,侧重考查学生分析解决问题能力,难度中等.

| A. | Cu是氧化剂 | B. | FeCl3是还原剂 | ||
| C. | Cu在反应中失去电子 | D. | FeCl3发生氧化反应 |
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min 时测得 n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol/min | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
| A. | 前2 s,以N2O4的浓度表示的平均反应速率为 0.01 mol•L-1•s-1 | |
| B. | 在2 s时体系内的压强为开始时的1.1倍 | |
| C. | 在平衡时体系内含N2O40.25 mol | |
| D. | 平衡时,如果压缩容器容积,则可提高N2O4的转化率 |
( )
| A. | (3)(7)(9)(10)(11)(12) | B. | (3)(7)(9)(10)(11)(14) | C. | (3)(7)(8)(9)(10)(11)(12) | D. | (1)(3)(7)(8)(9)(10)(11)(12) |
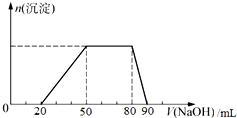 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | CO32-、AlO2-、NO3- |
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
| A. | 1molFe与足量盐酸反应,转移的电子总数为1.806×1024个 | |
| B. | 常温常压下,1 mol羟基(-OH)所含电子数为6.02×1024个 | |
| C. | 常温常压下,34g H2O2中含有共用电子对数为1.806×1024个 | |
| D. | 58.5gNaCl晶体中离子总数为6.02×1023个 |