题目内容
6.银锌电池广泛用于各种电子仪器,电池反应:Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2,下列说法正确的是( )| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
分析 A、该电池放电时,化学能转化为电能,且能自发发生氧化还原反应,Zn失电子化合价升高,Ag元素得电子化合价降低;
B、充电时,阳极上Ag失电子发生氧化反应;
C、根据电池反应式知,Zn和氢氧根离子反应生成Zn(OH)2,电解质溶液呈碱性;
D、放电时的正极,充电时作阳极;
解答 解:A、放电时Zn失电子发生氧化反应为负极,故A错误;
B、充电时,阳极上Ag失电子发生氧化反应,电极反应式为2Ag+2OH--2e-=Ag2O+H2O,故B正确;
C、根据电池反应式知,Zn和氢氧根离子反应生成Zn(OH)2,电解质溶液呈碱性,故C错误;
D、充电时电流从Ag电极经电解质溶液流向外接电源的负极,故D错误;
故选B.
点评 本题考查化学电源新型电池,根据反应的自发性与否确定原电池和电解池,明确各个电极上发生的反应,知道原电池、电解池的判断方法,题目难度不大.

练习册系列答案
相关题目
16.在四个不同的容器中,进行2A(g)+3B(g)?4C(g)+D(g)反应.根据在相同时间内测定的结果判断,生成C的速率最快的是( )
| A. | v(A)=0.3mol.L-1.min-1 | B. | v(B)=0.4 mol.L-1.min-1 | ||
| C. | v(C)=0.7 mol.L-1.min-1 | D. | v(D)=0.2 mol.L-1.min-1 |
17.下列说法正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 原子弹爆炸是放热反应 | |
| C. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨能量低且键能小 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②可得反应C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ•mol-1 |
14.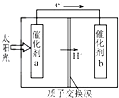 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法正确的是( )| A. | 该过程可以实现太阳能与电能的直接转换 | |
| B. | 催化剂a表面发生氧化反应,有O2产生 | |
| C. | 催化剂b附近酸性增强,催化剂a附近酸性减弱 | |
| D. | 催化剂a表面的反应是CO2+2H++2e-═HCOOH |
18.某“84消毒液”的包装说明如下:
下列说法不正确的是( )
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
16.下列物质性质与应用对应关系不正确的是( )
| A. | 汽油与水互不相溶,可用裂化汽油萃取溴水中的溴 | |
| B. | 明矾能水解生成氢氧化铝胶体,可用作水的净化剂 | |
| C. | Na2CO3溶液具有碱性,可用热的浓Na2CO3溶液洗涤试管内壁的油污 | |
| D. | Mg(OH)2受热分解生成H2O和MgO且△H>0,可用Mg(OH)2作阻燃剂 |
17.下列过程属于人工固氮的是( )
| A. | 分离液态空气制氮气 | |
| B. | 闪电将空气中的N2转化成NO | |
| C. | 工业上合成氮 | |
| D. | 豆科植物将空气中的N2转化为化合态氮 |
 如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题: