题目内容
1.利用反应Zn+2FeCl3═ZnCl2+2FeCl2组成一个化学电池,若电解质溶液为100mL 0.5mol/L FeCl3溶液,溶液中FeCl3全部被还原为FeCl2时,溶液中ZnCl2的物质的量浓度是多少?导线上通过的电子的物质的量是多少?分析 根据反应方程式Zn+2FeCl3═ZnCl2+2FeCl2,参加反应的n(FeCl3)=0.5mol/L×0.1L=0.05mol,计算生成ZnCl2的物质的量,进而计算其浓度;有1mol氯化铁反应转移电子1mol,据此分析.
解答 解:根据反应方程式Zn+2FeCl3═ZnCl2+2FeCl2,参加反应的n(FeCl3)=0.5mol/L×0.1L=0.05mol,则生成n(ZnCl2)=$\frac{0.05mol}{2}$=0.025mol,所以c(ZnCl2)=$\frac{0.025mol}{0.1L}$=0.25mol/L;
有1mol氯化铁反应转移电子1mol,0.05mol氯化铁反应转移电子的物质的量为0.05mol,
答:溶液中ZnCl2的物质的量浓度是0.25mol/L;导线上通过的电子的物质的量是0.05mol.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,计算的关键是搞清反应原理.

练习册系列答案
相关题目
11.丙烯酸的结构简式为CH2=CH-COOH,下列说法不正确的是( )
| A. | 与钠反应放出氢气 | B. | 能与新制的Cu(OH)2悬浊液反应 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 能发生加聚反应生成高分子化合物 |
12.下列反应中,属于加成反应的是( )
| A. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$ CH3COOCH2CH3+H2O | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$2CH3COOH | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$ -Br+HBr -Br+HBr |
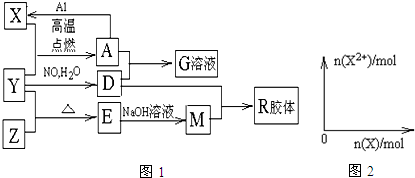
9. 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表
用化学用语答下列问题:
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为
(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
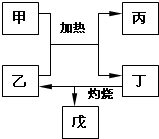
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为

(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
6.银锌电池广泛用于各种电子仪器,电池反应:Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2,下列说法正确的是( )
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
13.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
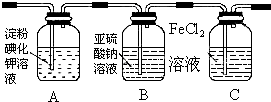
(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
11.根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是( )
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
12.为了探究锌与盐酸反应过程中的速率变化,某学生在100mL稀盐酸中加入足量锌粉,用排水量气法收集反应产生的气体,实验记录如下(累计值,体积已换算成标准状况下):
(1)该反应过程中的速率变化情况是先增大后减小(填“逐渐增大”等等),原因是开始时因反应放热速率增大,随反应进行盐酸浓度降低,速率减小.
(2)求2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L.min).
(3)为了减缓反应速率而又不减少产生氢气的量,可在盐酸中加入下列溶液中的AD(填编号).
A.蒸馏水 B.NaNO3溶液 C.Na2CO3溶液 D.CH3COONa溶液 E.CuSO4溶液.
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 0 | 50 | 120 | 232 | 290 | 310 |
(2)求2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L.min).
(3)为了减缓反应速率而又不减少产生氢气的量,可在盐酸中加入下列溶液中的AD(填编号).
A.蒸馏水 B.NaNO3溶液 C.Na2CO3溶液 D.CH3COONa溶液 E.CuSO4溶液.
 .
.