题目内容
17.下列说法正确的是( )| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 原子弹爆炸是放热反应 | |
| C. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨能量低且键能小 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②可得反应C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ•mol-1 |
分析 A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
B.原子弹爆炸是核裂变;
C.键能越大,键越稳定;
D.依据盖斯定律将方程式变形计算解答.
解答 解:A.水的状态为气态,产物为不是稳定氧化物,△H不代表燃烧热,故A错误;
B.原子弹爆炸属于裂变,不属于化学变化,故B错误;
C.C(石墨,s)=C(金刚石,s)△H>0,石墨键能更大,更稳定,故C错误;
D.依据盖斯定律$\frac{(①-②)}{2}$,得C(s)+CO2(g)=2CO(g) 的△H=+172.5kJ•mol-1,故D正确;
故选:D.
点评 本题考查了燃烧热、反应热的概念和计算,熟悉概念、盖斯定律的应用是解题关键,题目难度不大,注意核裂变属于物理变化

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
7.可逆反应2SO2(g)+O2(g)?2SO3(g)在恒容密闭容器中达到平衡,下列说法正确的是( )
| A. | SO2和O2不再化合,反应停止了 | |
| B. | 容器内压强保持不变 | |
| C. | SO2、O2和 SO3的浓度相等 | |
| D. | SO2、O2和 SO3的物质的量之比为2:1:2 |
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L己烷中的分子数约为NA个 | |
| B. | 常温常压下,在18 g H218O中含有NA个水分子 | |
| C. | 标准状况下,15 g CH3CH3所含共价键数为3.5NA个 | |
| D. | 电解精炼铜时,若电路中转移的电子数为2NA个,则阳极质量减轻64 g |
5.如图是某可逆反应在反应过程中的各物质的物质的量(v)与时间(t)的关系曲线.下列叙述正确的是( )


| A. | t1~t2时,只有正方向反应 | B. | t3~t4,反应不再发生 | ||
| C. | t3时,反应达到平衡 | D. | t3~t4,各物质的浓度相等 |
12.下列反应中,属于加成反应的是( )
| A. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$ CH3COOCH2CH3+H2O | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$2CH3COOH | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. | 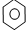 +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$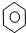 -Br+HBr -Br+HBr |
2.下列关于有机物的说法正确是( )
| A. | 乙烯、氯乙烯都属于不饱和烃 | |
| B. | 油脂、葡萄糖都能发生水解反应 | |
| C. | 乙酸、乙酸乙酯都不能与金属Na反应 | |
| D. | 苯能发生加成反应 |
9. 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表
用化学用语答下列问题:
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为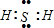
(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为
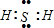
(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
6.银锌电池广泛用于各种电子仪器,电池反应:Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2,下列说法正确的是( )
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |