题目内容
17.下列过程属于人工固氮的是( )| A. | 分离液态空气制氮气 | |
| B. | 闪电将空气中的N2转化成NO | |
| C. | 工业上合成氮 | |
| D. | 豆科植物将空气中的N2转化为化合态氮 |
分析 A、分离液态空气制氮气,是氮气的状态发生改变;
B、闪电时N2转化为NO,属于自然固氮;
C、工业合成氨是N2与H2在一定条件下反应生成NH3;
D、豆科作物根瘤菌将N2转化为含氮化合物,属于生物固氮.
解答 解:A、分离液态空气制氮气,是氮气的状态发生改变,不属于氮的固定,更不是人工固氮,故A错误;
B、闪电时N2转化为NO,属于自然固氮,故B错误;
C、工业合成氨是N2与H2在一定条件下反应生成NH3,属于人工固氮,故C正确;
D、豆科作物根瘤菌将N2转化为含氮化合物,属于生物固氮,故D错误.
故选C.
点评 本题考查学生氮的固定以及分类方面的知识,注意知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
6.银锌电池广泛用于各种电子仪器,电池反应:Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2,下列说法正确的是( )
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
12.为了探究锌与盐酸反应过程中的速率变化,某学生在100mL稀盐酸中加入足量锌粉,用排水量气法收集反应产生的气体,实验记录如下(累计值,体积已换算成标准状况下):
(1)该反应过程中的速率变化情况是先增大后减小(填“逐渐增大”等等),原因是开始时因反应放热速率增大,随反应进行盐酸浓度降低,速率减小.
(2)求2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L.min).
(3)为了减缓反应速率而又不减少产生氢气的量,可在盐酸中加入下列溶液中的AD(填编号).
A.蒸馏水 B.NaNO3溶液 C.Na2CO3溶液 D.CH3COONa溶液 E.CuSO4溶液.
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 0 | 50 | 120 | 232 | 290 | 310 |
(2)求2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L.min).
(3)为了减缓反应速率而又不减少产生氢气的量,可在盐酸中加入下列溶液中的AD(填编号).
A.蒸馏水 B.NaNO3溶液 C.Na2CO3溶液 D.CH3COONa溶液 E.CuSO4溶液.
2.溶液中常见离子的检验及结论正确的是( )
| A. | 取样,若加入淀粉溶液,溶液显蓝色,则一定有I- | |
| B. | 取样,若加入AgNO3溶液由白色沉淀,则一定有Cl- | |
| C. | 取样,若加入BaCl2溶液,有白色沉淀产生,则一定有SO42- | |
| D. | 取样,若加入NaOH溶液,微热,产生使湿润红色石蕊试纸变蓝的气体,则一定有NH4+ |
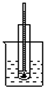
9.如图所示,是由碳棒、铁片和氯化铜溶液组成的原电池,下列叙述正确的是( )
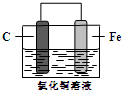

| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |
7.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g),经过一段时间后达到平衡.反应过程中测定的t/s-n(PCl3)/mol数据如图.下列说法正确的是( )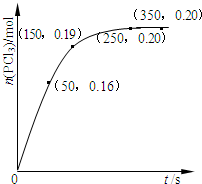

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |