题目内容
18.某“84消毒液”的包装说明如下:| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
分析 根据c=$\frac{1000ρω}{M}$计算84消毒液的c(NaClO),以此可知c(Na+),以及配制一定体积所需NaClO的质量,与CO2发生反应可生成碳酸钠或碳酸氢钠,以此解答该题.
解答 解:A.c=$\frac{1000ρω}{M}$=$\frac{1000×1.198g/L×25%}{74.5g/mol}$≈4.0mol•L-1 ,故A正确;
B.一瓶该“84消毒液”含有NaClO的物质的量为1L×4.0mol/L=4mol,如与二氧化碳反应生成碳酸钠,则需要2molCO2,标况下体积为2mol×22.4L/mol=44.8L,故B正确;
C.稀释100倍,浓度为原来的$\frac{1}{100}$.考虑浓度变化,c(Na+)约为0.04 mol•L-1,故C正确;
D.实验室不存在480mL容量瓶,应用500mL容量瓶配制,则n(NaClO)=0.5L×4.0mol/L=2.0mol,m(NaClO)=2.0mol×74.5g/mol=149g,故D错误.
故选D.
点评 本题考查物质的量浓度的计算,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L己烷中的分子数约为NA个 | |
| B. | 常温常压下,在18 g H218O中含有NA个水分子 | |
| C. | 标准状况下,15 g CH3CH3所含共价键数为3.5NA个 | |
| D. | 电解精炼铜时,若电路中转移的电子数为2NA个,则阳极质量减轻64 g |
9. 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表
用化学用语答下列问题:
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为
(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
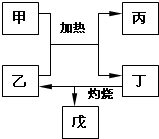
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)E在元素周期表中的位置为第四周期第Ⅷ族;Z的氢化物电子式为

(2)X、Y、D形成的简单离子的半径由大到小为Cl->O2->Al3+.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,D的最高价氧化物溶于强碱的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和 EY3两种化合物,下列说法正确的是(填序号)①②③.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)如图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式AlCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3HCl↑.
6.银锌电池广泛用于各种电子仪器,电池反应:Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2,下列说法正确的是( )
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
13.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
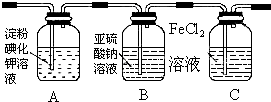
(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
4.常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
分析实验记录,甲认为导致Fe3+浓度过低的原因是加入氯化铁的量过少,导致铁离子浓度过小;乙同学结合平衡移动的知识,认为还有一个原因是用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小.
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池
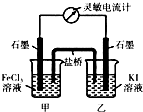
①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池

①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
11.根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是( )
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
9.如图所示,是由碳棒、铁片和氯化铜溶液组成的原电池,下列叙述正确的是( )


| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |