题目内容
11.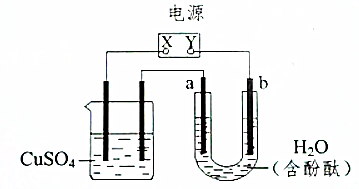 如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:(1)电源的X极是正极;
(2)若左侧烧杯中也为惰性电极,溶液发生的电极反应为阳极电极反应式为4OH--4e-=2H2O+O2↑,阴极电极反应式为2Cu2++4e-=2Cu;总反应式为2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑;
(3)若将右侧溶液倒入另一空烧杯中,充分搅拌,溶液呈无色.
分析 (1)U形管中是电解水,b电极附近呈红色,说明b电极附近显碱性,氢离子在b电极放电,所以Y为负极,b为阴极;
(2)电解硫酸铜溶液时,阳极上会产生氧气,阴极上会产生金属铜;
(3)电解酚酞的水溶液后的溶液仍显中性.
解答 解:(1)通电电解酚酞的水溶液时,b极附近溶液呈红色,说明b连接的Y为电源的负极,则X为正极,故答案为:正;
(2)电解硫酸铜时,阳极上会产生氧气,阳极电极反应式为4OH--4e-=2H2O+O2↑,阴极上会产生金属铜,阴极电极反应式为2Cu2++4e-=2Cu,总反应为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,故答案为:阳极电极反应式为4OH--4e-=2H2O+O2↑,阴极电极反应式为2Cu2++4e-=2Cu;2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑;
(3)电解酚酞的水溶液,就是电解水,电解后溶液显中性,电解后的溶液倒入另一空烧杯中充分搅拌,溶液显无色,故答案为:无.
点评 本题考查电解池的工作原理知识,题目难度中等,注意根据电极现象判断电源的正负极为解答该题的关键.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
1.试剂B、C分别是( )
| A. | NaOH、CuSO4 | B. | NaOH、新制Cu(OH)2 | C. | Na2CO3、CuSO4 | D. | H2SO4、新制Cu(OH)2 |
2.下列关于有机物的说法正确是( )
| A. | 乙烯、氯乙烯都属于不饱和烃 | |
| B. | 油脂、葡萄糖都能发生水解反应 | |
| C. | 乙酸、乙酸乙酯都不能与金属Na反应 | |
| D. | 苯能发生加成反应 |
19. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg;
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
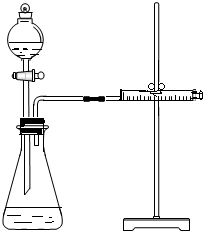
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应速率Mg>Fe,Cu反应最慢 | 金属性质越活泼,反应 速率越快 |
(2)甲同学的实验目的是探究金属(反应物)本身的性质与反应速率的关系;要得出正确的实验结论,还需要控制的实验条件是温度相同.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间;
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
6.银锌电池广泛用于各种电子仪器,电池反应:Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2,下列说法正确的是( )
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
4.常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
分析实验记录,甲认为导致Fe3+浓度过低的原因是加入氯化铁的量过少,导致铁离子浓度过小;乙同学结合平衡移动的知识,认为还有一个原因是用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小.
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池
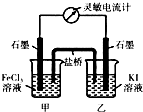
①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池

①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
1.在常温下进行下列实验,有关图象与对应叙述相符的是( )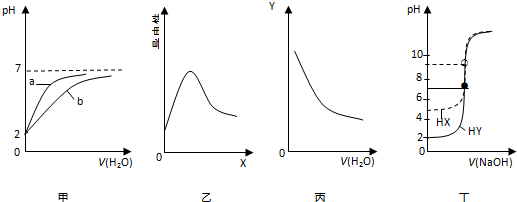

| A. | 图甲表示pH均为2的盐酸和醋酸分别用水稀释时pH变化曲线,其中a为醋酸 | |
| B. | 图乙表示0.1 mol•L-1 醋酸中加入X后溶液导电性曲线,则X可能是0.1 mol•L-1 氨水 | |
| C. | 图丙表示0.1 mol•L-1 氨水不断用水稀释曲线,Y可能是c(OH-) | |
| D. | 图丁表示0.0100 mol•L-1 NaOH溶液分别滴定20.00 mL 浓度均为0.0100 mol•L-1HX和HY的滴定曲线,可判断HX酸性比HY强 |
2.溶液中常见离子的检验及结论正确的是( )
| A. | 取样,若加入淀粉溶液,溶液显蓝色,则一定有I- | |
| B. | 取样,若加入AgNO3溶液由白色沉淀,则一定有Cl- | |
| C. | 取样,若加入BaCl2溶液,有白色沉淀产生,则一定有SO42- | |
| D. | 取样,若加入NaOH溶液,微热,产生使湿润红色石蕊试纸变蓝的气体,则一定有NH4+ |