题目内容
【题目】硫酸年产量的高低可衡量一个国家化工生产水平发展的高低,SO2转化为SO3是制备硫酸中的关键性反应,也是一个可逆反应。
(1)NO可作为SO2与O2间反应的催化剂,催化机理如下:
①2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
②SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH2
SO3(g)+NO(g) ΔH2
总反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
(2)一定温度下,向容积为2L的恒容密闭容器中充入2molSO2、2mo1O2测得容器中压强的变化如下表所示(SO3为气体):
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/MPa | 16.0a | 14.7a | 13.7a | 13.0a | 12.5a | 12.4a | 12.4a |
①0~10min内,υ(SO2)=_________
②该温度下的平衡常数K=__(结果保留一位小数)。
③反应达到平衡后,再向容器中同时充入均为0.2mol的三种气体后,υ(正)、υ(逆)的关系是___
(3)一定温度下,向某密闭容器中通入一定量的二氧化硫和氧气的混合气体并使之反应,反应过程中SO2、O2、SO3物质的量变化如下图所示:
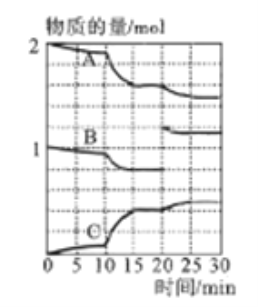
①A、B、C三条曲线中表示SO2物质的量的变化的是__,若在15~20min、25~30min两个时间段内容器容积不变,则在某一时刻SO3的分解速率较大的时间段是_______。
②10~15min内反应速率发生了明显变化,其可以的原因有__________
(4)常温下,用NaOH溶液吸收SO2既可消除SO2造成的大气污染,也可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶液的pH=______(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7
【答案】 -41.8kJ/mol 0.09 mol/(L·min) 147.3 υ(正)>υ(逆) A 25~30 min 加压、使用催化剂 9
【解析】试题分析:本题考查盖斯定律的应用、化学反应速率和化学平衡常数的计算、化学平衡图像的分析、外界条件对化学反应速率和化学平衡的影响、pH的计算。
(1)应用盖斯定律,将①+②![]() 2得,2SO2(g)+O2(g)
2得,2SO2(g)+O2(g)![]() 2SO3(g)ΔH3=ΔH1+2ΔH2=(-113kJ/mol)+2
2SO3(g)ΔH3=ΔH1+2ΔH2=(-113kJ/mol)+2![]() ΔH2=-196.6kJ/mol;ΔH2=-41.8kJ/mol。
ΔH2=-196.6kJ/mol;ΔH2=-41.8kJ/mol。
(2)①设从起始到平衡过程中转化O2物质的量为xmol,用三段式
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
n(起始)(mol) 2 2 0
n(转化)(mol) 2x x 2x
n(平衡)(mol)2-2x 2-x 2x
10min和12min时压强相等,说明10min时反应已经达到平衡状态且平衡时容器内压强为12.4a,根据恒温恒容下气体的压强之比等于气体物质的量之比,![]() =
=![]() ,解得x=0.9,0~10min内,υ(SO2)=
,解得x=0.9,0~10min内,υ(SO2)=![]() =0.09mol/(L·min)。
=0.09mol/(L·min)。
②平衡时SO2、O2、SO3物质的量依次为0.2mol、1.1mol、1.8mol,平衡时SO2、O2、SO3物质的量浓度依次为0.1mol/L、0.55mol/L、0.9mol/L,该温度下的平衡常数K=![]() =
=![]() =147.3。
=147.3。
③反应达到平衡后,再向容器中同时充入均为0.2mol的三种气体,此时SO2、O2、SO3物质的量浓度依次为0.2mol/L、0.65mol/L、1.0mol/L,Qc=![]() =38.5
=38.5![]() 147.3,反应正向进行,υ(正)
147.3,反应正向进行,υ(正)![]() υ(逆)。
υ(逆)。
(3)①开始一段时间A、B物质的量随着时间的推移减小,A、B为反应物,C开始为0,随着时间的推移增加,C为生成物,且A、B、C在相同时间内的转化物质的量之比为2:1:2,根据反应2SO2(g)+O2(g)![]() 2SO3(g),A表示SO2物质的量的变化,B表示O2物质的量的变化,C表示SO3物质的量的变化。0~15min时间段为建立平衡,0~15minSO3的分解速率随着时间的推移增大;15~20min时间段内各物质的浓度不变,保持平衡状态,SO3的分解速率不变;根据图像,20min时向容器中充入0.4molO2,瞬时正反应速率变大,逆反应速率不变,平衡向正反应方向移动,20~25min时间段内,SO3的分解速率增大;25min时达到新平衡,25~30min时间段内保持新平衡状态,SO3的分解速率不变;则SO3的分解速率较大的时间段是25~30min。
2SO3(g),A表示SO2物质的量的变化,B表示O2物质的量的变化,C表示SO3物质的量的变化。0~15min时间段为建立平衡,0~15minSO3的分解速率随着时间的推移增大;15~20min时间段内各物质的浓度不变,保持平衡状态,SO3的分解速率不变;根据图像,20min时向容器中充入0.4molO2,瞬时正反应速率变大,逆反应速率不变,平衡向正反应方向移动,20~25min时间段内,SO3的分解速率增大;25min时达到新平衡,25~30min时间段内保持新平衡状态,SO3的分解速率不变;则SO3的分解速率较大的时间段是25~30min。
②根据图像,10min时SO2、O2、SO3物质的量都没有骤变,10~15min内反应速率比0~10min内明显增大,根据外界条件对化学反应速率的影响,可能的原因是:加压、使用催化剂。
(4)H2SO3的电离方程式为:H2SO3![]() H++HSO3-、HSO3-
H++HSO3-、HSO3-![]() H++SO32-,根据电离平衡常数的概念K1(H2SO3)=
H++SO32-,根据电离平衡常数的概念K1(H2SO3)=![]() =1.5
=1.5![]() 10-2,K2(H2SO3)=
10-2,K2(H2SO3)=![]() =1
=1![]() 10-7;若某吸收液中c(HSO3-):c(SO32-)=1:100,由于SO32-比HSO3- 多得多,溶液中水解平衡为SO32-+H2O
10-7;若某吸收液中c(HSO3-):c(SO32-)=1:100,由于SO32-比HSO3- 多得多,溶液中水解平衡为SO32-+H2O![]() HSO3-+OH-,该水解平衡常数=
HSO3-+OH-,该水解平衡常数=![]() =
=![]() =
=![]() =1
=1![]() 10-7,将c(HSO3-):c(SO32-)=1:100代入,解得c(OH-)=1
10-7,将c(HSO3-):c(SO32-)=1:100代入,解得c(OH-)=1![]() 10-5mol/L,则c(H+)=1
10-5mol/L,则c(H+)=1![]() 10-9mol/L,溶液的pH=-lgc(H+)=9。
10-9mol/L,溶液的pH=-lgc(H+)=9。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案