题目内容
【题目】NaC1O 常用于配制消毒液,它属于
A.酸B.碱C.盐D.氧化物
【答案】C
【解析】
根据酸的概念电离时产生的阳离子全部都是氢离子的化合物,叫酸;碱的概念电离时产生的阴离子全部都是氢氧根离子的化合物,叫碱;氧化物的概念由两种元素组成,其中一种元素是氧元素的化合物,叫氧化物;盐的概念是电离后含有金属阳离子(或NH4+)和酸根离子的化合物,以此解题。
由上分析可知,NaC1O电离既不产生H+,也不产生OH-,则NaClO不属于酸,也不属于碱,NaClO由三种元素构成,也不属于氧化物,NaClO电离产生钠离子和次氯酸根,符合盐的概念,因而NaClO属于盐;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】硫酸年产量的高低可衡量一个国家化工生产水平发展的高低,SO2转化为SO3是制备硫酸中的关键性反应,也是一个可逆反应。
(1)NO可作为SO2与O2间反应的催化剂,催化机理如下:
①2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
②SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH2
SO3(g)+NO(g) ΔH2
总反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
(2)一定温度下,向容积为2L的恒容密闭容器中充入2molSO2、2mo1O2测得容器中压强的变化如下表所示(SO3为气体):
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/MPa | 16.0a | 14.7a | 13.7a | 13.0a | 12.5a | 12.4a | 12.4a |
①0~10min内,υ(SO2)=_________
②该温度下的平衡常数K=__(结果保留一位小数)。
③反应达到平衡后,再向容器中同时充入均为0.2mol的三种气体后,υ(正)、υ(逆)的关系是___
(3)一定温度下,向某密闭容器中通入一定量的二氧化硫和氧气的混合气体并使之反应,反应过程中SO2、O2、SO3物质的量变化如下图所示:
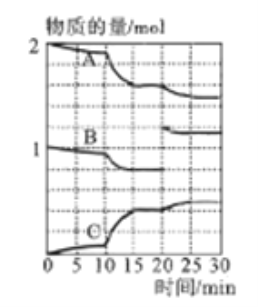
①A、B、C三条曲线中表示SO2物质的量的变化的是__,若在15~20min、25~30min两个时间段内容器容积不变,则在某一时刻SO3的分解速率较大的时间段是_______。
②10~15min内反应速率发生了明显变化,其可以的原因有__________
(4)常温下,用NaOH溶液吸收SO2既可消除SO2造成的大气污染,也可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶液的pH=______(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7
【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
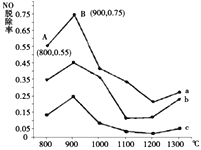
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。