题目内容
【题目】用铁钉和稀硫酸发生反应,下列措施能加快反应速率的是( )
A.降低反应温度B.加水稀释
C.将铁钉换成铁粉D.将稀硫酸替换为98%的浓硫酸
【答案】C
【解析】
A. 降低反应温度,反应速率减慢,故A不符合题意;
B. 加水稀释,稀硫酸的浓度减小,反应速率减慢,故B不符合题意;
C. 将铁钉换成铁粉增大了反应物之间的接触面积,反应速率加快,故C符合题意;
D. 将稀硫酸替换为98%的浓硫酸,浓硫酸具有强氧化性,常温下可使铁发生钝化现象,导致反应速率减慢,故D不符合题意;
答案选C。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】硫酸年产量的高低可衡量一个国家化工生产水平发展的高低,SO2转化为SO3是制备硫酸中的关键性反应,也是一个可逆反应。
(1)NO可作为SO2与O2间反应的催化剂,催化机理如下:
①2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
②SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH2
SO3(g)+NO(g) ΔH2
总反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
2SO3(g)ΔH3=-196.6kJ/mol ΔH2=__________
(2)一定温度下,向容积为2L的恒容密闭容器中充入2molSO2、2mo1O2测得容器中压强的变化如下表所示(SO3为气体):
反应时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/MPa | 16.0a | 14.7a | 13.7a | 13.0a | 12.5a | 12.4a | 12.4a |
①0~10min内,υ(SO2)=_________
②该温度下的平衡常数K=__(结果保留一位小数)。
③反应达到平衡后,再向容器中同时充入均为0.2mol的三种气体后,υ(正)、υ(逆)的关系是___
(3)一定温度下,向某密闭容器中通入一定量的二氧化硫和氧气的混合气体并使之反应,反应过程中SO2、O2、SO3物质的量变化如下图所示:
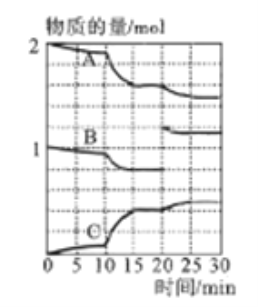
①A、B、C三条曲线中表示SO2物质的量的变化的是__,若在15~20min、25~30min两个时间段内容器容积不变,则在某一时刻SO3的分解速率较大的时间段是_______。
②10~15min内反应速率发生了明显变化,其可以的原因有__________
(4)常温下,用NaOH溶液吸收SO2既可消除SO2造成的大气污染,也可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶液的pH=______(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7