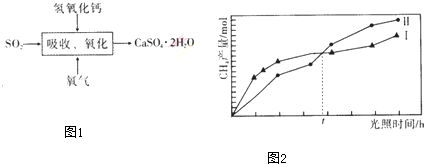
题目内容
6.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(3)③、④三种元素形成的离子,离子半径由大到小的顺序是r(F-)>r(Na+).
(4)④和⑨两种元素形成化合物的化学式为NaBr,该化合物燃烧时的焰色为黄色,
该化合物溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
分析 由元素在周期表中位置,可知①为N、②为O、③为F、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为Cl、⑨为Br、⑩为K.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强;
(2)同周期自左而右金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)④和⑨两种元素形成化合物为溴化钠,含有钠元素,该化合物燃烧时的焰色为黄色,溴化钠与氯气反应生成氯化钠与溴单质
解答 解:由元素在周期表中位置,可知①为N、②为O、③为F、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为Cl、⑨为Br、⑩为K.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中K最活泼,
故答案为:K;
(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(3)F-、Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:r(F-)>r(Na+),
故答案为:r(F-)>r(Na+);
(4)④和⑨两种元素形成化合物为溴化钠,化学式为NaBr,含有钠元素,该化合物燃烧时的焰色为黄色,溴化钠与氯气反应生成氯化钠与溴单质,反应方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:NaBr;黄色;Cl2+2Br-=2Cl-+Br2.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,注意基础知识的理解掌握.

练习册系列答案
相关题目
6.若发现了116号元素,并知它是第ⅥA族元素,则下列说法中不正确的是( )
| A. | 其钠盐的化学式为Na2X | B. | 最高价氧化物对应水化物为碱 | ||
| C. | X是金属元素 | D. | X单质是能导电的固体 |
7.现对卤素单质Cl2,Br2,I2的氧化性强弱进行探究,从而总结出在元素周期表中,同一主族元素非金属性变化规律.完成下列表格并得出结论
结论:(1)卤素单质Cl2,Br2,I2的氧化性由强到弱的顺序Cl2>Br2>I2
(2)同一主族元素从上到下非金属性逐渐减弱.
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
(2)同一主族元素从上到下非金属性逐渐减弱.
14.下列工业生产过程中涉及到反应热再利用的是( )
| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
1.X、Y、Z三种元素都是短周期元素,在元素周期表中位置如图,X和Z原子核内的质子数之和等于Y原子核内质子数,下列推断正确的是( )
| X | Z | |
| Y |
| A. | 原子半径:X>Y>Z | B. | 气态氢化物稳定性:X<Y<Z | ||
| C. | 元素的非金属性强弱:Y<X<Z | D. | Y和Z形成的是分子晶体 |
11.下列关于如图所示电化学装置的分析正确的是( )
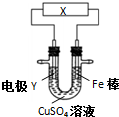

| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42- 移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
18.下列选项中的数值前者小于后者的是( )
| A. | 25℃和l00℃时H2O的KW | |
| B. | 同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) | |
| C. | 同温同浓度的NaHCO3溶液和CH3COONa溶液的pH | |
| D. | 中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
16.下列表示物质的化学用语或模型正确的是( )
| A. | 羟基的电子式: | B. | CH4分子的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 1,2-二甲基丁烷的结构简式为: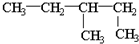 |