题目内容
15.煤是一种重要的化石能源.请回答:(1)煤的加工包括干馏、气化和液化,煤的液化技术又分为直接液化技术和间接液化技术.
(2)干熄焦技术是将炼焦炉推出的约l000℃的赤热焦炭,在熄焦室中被与其逆流的冷惰性气体熄灭,逆流通人惰性气体的原因是充分进行热交换.
(3)某工厂每天要烧掉含硫1.6%的烟煤200吨,排放出大量的SO2,如果将这些SO2回收利用,那么理论上每年(按365天计)可生产98%的浓硫酸3600吨.
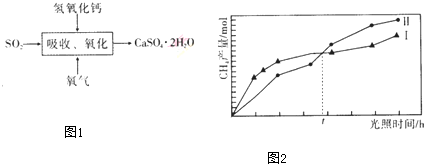
(4)石膏法脱硫是烟气脱硫技术中最成熟的一种方法,工艺如图1,吸收、氧化过程的化学方程式为
2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O.实际生产时采用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2,主要原因是石灰石浆液的成本较熟石灰的低
(5)煤燃烧产生的CO2在光能和光催化剂存在的条件下可与H2O(g)转化为CH4和O2,反应的化学方程式为CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(I、Ⅱ)作用下,CH4产量随光照时间的变化如图2所示,光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,其原因可能是催化剂的活性受光照时间的影响
分析 (1)煤的加工分为干馏、气化和液化,煤的液化分为直接液化和间接液化;
(2)逆流通人惰性气体增大接触面积,充分进行热交换,故答案为:充分进行热交换;
(3)根据反应的关系式:S~SO2~H2SO4计算生成硫酸的质量,进而计算98%浓硫酸的质量;
(4)根据工艺图可知,SO2被氧气在Ca(OH)2存在的环境下氧化为石膏CaSO4•2H2O,据此写出化学方程式,从石灰石浆液的成本较熟石灰低;
(5)根据反应物为CO2和H2O(g)产物为CH4和O2来书写化学方程式;催化剂受光照时间的影响.
解答 解:(1)煤的加工分为干馏、气化和液化,煤的液化分为直接液化和间接液化,煤的直接液化是将煤在氢气和催化剂作用下通过加氢裂化转变为液体燃料的过程,因过程主要采用加氢手段,故又称煤的加氢液化法,煤的间接液化是先把煤炭在高温下与氧气和水蒸气反应,使煤炭全部气化、转化成合成气(一氧化碳和氢气的混合物),然后再在催化剂的作用下合成为液体燃料的工艺技术,故答案为:气化,直接液化技术;间接液化技术;!
(2)逆流通人惰性气体可充分进行热交换,
(3)每天燃烧掉的烟煤中S的质量=200t×1.6%=3.2t,
S~SO2~H2SO4
32 98
3.2t×360 m(H2SO4)
m(H2SO4)=$\frac{3.2t×360×98}{32}$=3528t,
故得到98%的浓硫酸的质量为:$\frac{3528t}{98%}$=3600t,
故答案为:3600t;
(4)根据工艺图可知,SO2被氧气在Ca(OH)2存在的环境下氧化为石膏CaSO4•2H2O,故化学方程式为:2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O,而由于石灰石浆液的成本较熟石灰低,故使用石灰石浆液而不用熟石灰,故答案为:2SO2+O2+2Ca(OH)2+4H2O=2CaSO4•2H2O,石灰石浆液的成本较熟石灰低;
(5)根据反应物为CO2和H2O(g)产物为CH4和O2可知化学方程式为:CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2;光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,说明光照能提高催化剂的活性,故答案为:CO2+2H2O(g)$\frac{\underline{\;催化剂\;}}{光照}$CH4+2O2;催化剂的活性受光照时间的影响.
点评 本题考查了煤的综合利用和化学方程式的书写,综合性较强,应注意的是煤的综合利用是高频考点.

 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案| A. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| B. | HCl中存在离子键,属于离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(3)③、④三种元素形成的离子,离子半径由大到小的顺序是r(F-)>r(Na+).
(4)④和⑨两种元素形成化合物的化学式为NaBr,该化合物燃烧时的焰色为黄色,
该化合物溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
| A. | 用分液法分离碘酒和CCl4 | |
| B. | 用饱和碳酸钠溶液萃取乙醇中的乙酸 | |
| C. | 用银氨溶液鉴别甲酸乙酯和乙醛 | |
| D. | 用浓溴水鉴别苯和环己烯 |
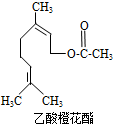 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ③④⑥ |
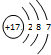 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 该粒子的化学式为Cl- | ||
| C. | 元素的最低化合价为-1 | D. | 与活泼金属反应时容易得电子 |
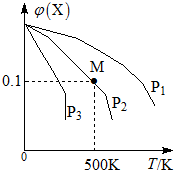 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
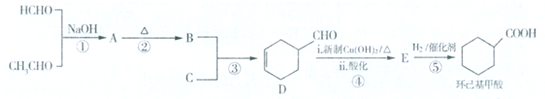
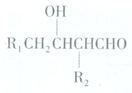 或
或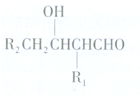
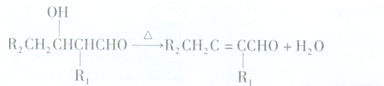
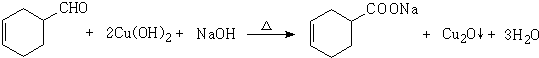 .
. 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.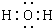 .
.