题目内容
16.下列表示物质的化学用语或模型正确的是( )| A. | 羟基的电子式: | B. | CH4分子的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 1,2-二甲基丁烷的结构简式为: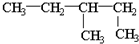 |
分析 A、根据阴离子电子式的书写方法来判断;
B、根据球棍模型和比例模型知识来回答;
C、烯烃中含有官能团双键,结构简式中不能省略双键;
D、烷烃命名中出现1-甲基,说明选取主链不是最长.
解答 解:A、氢氧根离子中,氢原子和氧原子之间通过共价键相连,电子式为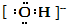 ,羟基电子式为
,羟基电子式为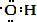 ,故A错误;
,故A错误;
B、该模型是甲烷分子的比例模型,故B正确;
C、乙烯的结构简式:CH2=CH2,故C错误;
D、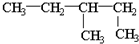 ,此为烷烃,最长碳链为5,在3号碳上存在1个甲基,故正确命名为:3-甲基-戊烷,故D错误,故选B.
,此为烷烃,最长碳链为5,在3号碳上存在1个甲基,故正确命名为:3-甲基-戊烷,故D错误,故选B.
点评 本题主要考查的是电子式书写、比例模型与球棍模型、烯烃结构简式表示方法、烷烃的命名等,难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
6.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:
(1)10种元素中,化学性质最活泼的金属是K.
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(3)③、④三种元素形成的离子,离子半径由大到小的顺序是r(F-)>r(Na+).
(4)④和⑨两种元素形成化合物的化学式为NaBr,该化合物燃烧时的焰色为黄色,
该化合物溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(3)③、④三种元素形成的离子,离子半径由大到小的顺序是r(F-)>r(Na+).
(4)④和⑨两种元素形成化合物的化学式为NaBr,该化合物燃烧时的焰色为黄色,
该化合物溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
4.某粒子的结构示意图为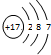 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )
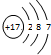 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 该粒子的化学式为Cl- | ||
| C. | 元素的最低化合价为-1 | D. | 与活泼金属反应时容易得电子 |
11.下列说法正确的是( )
| A. | 流水、风力是一次能源,电力、蒸汽是二次能源 | |
| B. | 普通锌锰电池是一次电池,碱性锌锰电池是二次电池 | |
| C. | 铅蓄电池是一次电池,氢氧燃料电池是二次电池 | |
| D. | 同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
1.下列有机物命名正确的是( )
| A. | 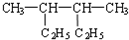 2,3-二乙基丁烷 | B. | 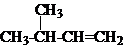 2-甲基-3-丁烯 | C. | 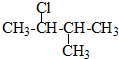 3-甲基-2-氯丁烷 | D. | 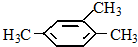 1,3,4-三甲苯 |
8.胡妥油(D)用作香料的原料,它可由A合成得到:
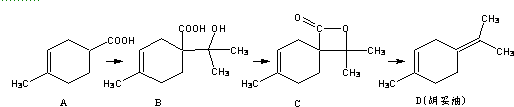
下列说法正确的是( )

下列说法正确的是( )
| A. | 1molA可与2molNaOH完全反应 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
5.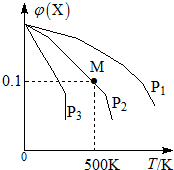 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
6.某同学为了探究外界条件对化学反应速率的影响,用50mL稀盐酸和1g碳酸钙在不同条件下反应,得到如下表数据.请仔细观察下表中实验数据,回答下列问题:
(1)该反应属于放热反应(填“吸热”或“放热).反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O.
(2)实验5、6目的是探究温度对反应速率的影响,结果说明当其他条件相同时,温度越高,反应速率越快.
(3)根据实验1、3、5或实验2、4可以得出条件对反应速率的影响规律是其他条件一定,反应物浓度越大,反应速率越快.
(4)从本实验数据中分析,影响化学反应速率的因素还有反应物的接触面积,能表明这一规律的两个实验序号是1和2.
| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6目的是探究温度对反应速率的影响,结果说明当其他条件相同时,温度越高,反应速率越快.
(3)根据实验1、3、5或实验2、4可以得出条件对反应速率的影响规律是其他条件一定,反应物浓度越大,反应速率越快.
(4)从本实验数据中分析,影响化学反应速率的因素还有反应物的接触面积,能表明这一规律的两个实验序号是1和2.
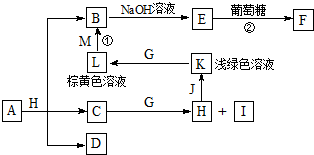 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.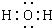 .
.