题目内容
14.下列工业生产过程中涉及到反应热再利用的是( )| A. | 接触法制硫酸 | B. | 联合法制纯碱 | ||
| C. | 铁矿石炼铁 | D. | 石油的裂化和裂解 |
分析 A、接触法制硫酸分三步,4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2; SO2+$\frac{1}{2}$O2═SO3 SO3+H2O═H2SO4,每一步都要发热;
B、联合法制纯碱分二步,主要是先向饱和氯化钠溶液中通氨气、二氧化碳生成碳酸氢钠晶体,过滤得碳酸氢钠在加热分解生成纯碱;
C、铁矿石炼铁主要是一氧化碳还原氧化铁,该反应吸热;
D、石油的裂化裂解是在高温下使含碳个数多的烃分解的过程,需要吸热;
解答 解:A、接触法制硫酸分三步,4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2; SO2+$\frac{1}{2}$O2═SO3 SO3+H2O═H2SO4,每一步都要发热,所以为了节约能源,可以将接触法制硫酸放出的热量进行再利用,故A正确;
B、联合法制纯碱分二步,主要是先向饱和氯化钠溶液中通氨气、二氧化碳生成碳酸氢钠晶体,过滤得碳酸氢钠在加热分解生成纯碱,主要是需要吸热,所以不涉及到反应热再利用,故B错误;
C、在炼铁过程中,焦炭先跟热空气中的氧气发生反应,生成二氧化碳,二氧化碳再与炽热的焦炭反应,生成一氧化碳,一氧化碳在还原氧化铁,主要是需要吸热,所以不涉及到反应热再利用,故C错误;
D、石油的裂化裂解是在高温下使含碳个数多的烃分解的过程,需要吸热,所以不涉及到反应热再利用,故D错误.
故选:A.
点评 主要考查了工业生成,注意接触法制硫酸每一步都要发热,所以为了节约能源,可以将接触法制硫酸放出的热量进行再利用.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
15.下列说法中正确的是( )
| A. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| B. | HCl中存在离子键,属于离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
9.25℃,有v1mLpH≈9的氨水(A)和v2mLpH≈10的氨水(B),v3mLpH=10的NaOH溶液(C),它们能中和同量的盐酸,以下叙述正确的是( )
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2≈v3 | |
| D. | 中和热A=B=C |
19.某阴离子X2-有m个电子,其质量数为a,则核内中子数为( )
| A. | m+2 | B. | m+5 | C. | a-m+2 | D. | a-m-2 |
6.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:
(1)10种元素中,化学性质最活泼的金属是K.
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(3)③、④三种元素形成的离子,离子半径由大到小的顺序是r(F-)>r(Na+).
(4)④和⑨两种元素形成化合物的化学式为NaBr,该化合物燃烧时的焰色为黄色,
该化合物溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH.
(3)③、④三种元素形成的离子,离子半径由大到小的顺序是r(F-)>r(Na+).
(4)④和⑨两种元素形成化合物的化学式为NaBr,该化合物燃烧时的焰色为黄色,
该化合物溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
4.某粒子的结构示意图为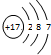 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )
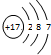 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 该粒子的化学式为Cl- | ||
| C. | 元素的最低化合价为-1 | D. | 与活泼金属反应时容易得电子 |


 或
或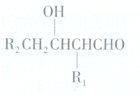
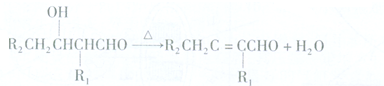
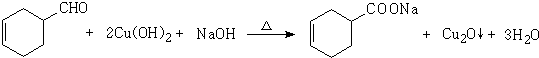 .
.