题目内容
2.下列离子方程式书写正确的是( )| A. | 钠和冷水反应:Na+H2O=Na++OH一+H2↑ | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl一 |
分析 A.H原子个数不守恒;
B.铁粉投入到硫酸铜溶液中发生置换反应生成硫酸亚铁和铜;
C.一水合氨为弱电解质应保留化学式;
D.电荷不守恒.
解答 解:A.钠和冷水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.铁粉投入到硫酸铜溶液中,反应生成硫酸亚铁和铜,离子方程式:Fe+Cu2+=Fe2++Cu,故B正确;
C.氯化铝加入过量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.氯化亚铁溶液中通入氯气,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式书写,明确反应实质,注意离子方程式应遵循原子个数、电荷数守恒规律,注意弱电解质应保留化学式即可解答,题目较简单.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
12.能用浓硫酸干燥的气体是( )
| A. | HI | B. | NH3 | C. | SO2 | D. | H2S |
13.如表除去括号内杂质所用的试剂和方法都正确的是( )
| 选项 | 物质 | 所用试剂 | 方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙醇(水) | 生石灰 | 分液 |
| C | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
10.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )
| A. | CuSO4 | B. | NaOH | C. | BaCl2 | D. | H2SO4 |
17.下列选项中,符合如图所示关系的是( )
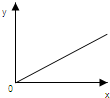

| A. | 一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系 | |
| B. | 铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系 | |
| C. | 将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系 | |
| D. | H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系 |
7.下列反应属于吸热反应的是( )
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | 过氧化钠与水反应 |
11.在容积不变的密闭容器中存在如下反应:2A(g)+B(g)?3C(g);△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )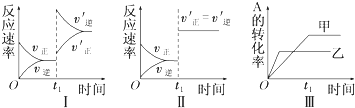

| A. | 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
12.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 加热能杀死流感病毒式因为病毒的蛋白质受热变性 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |