题目内容
13.如表除去括号内杂质所用的试剂和方法都正确的是( )| 选项 | 物质 | 所用试剂 | 方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙醇(水) | 生石灰 | 分液 |
| C | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯被高锰酸钾氧化生成二氧化碳;
B.CaO与水反应后,增大与乙醇的沸点差异;
C.乙酸与NaOH溶液反应后,增大与乙醇的沸点差异;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层.
解答 解:A.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应加溴水、洗气除杂,故A错误;
B.CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故B错误;
C.乙酸与NaOH溶液反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故C错误;
D.乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液可除杂,故D正确;
故选D.
点评 本题考查物质分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
3.氯化钠是日常生活中人们常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是( )
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
1.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子核外电子层排布呈周期性变化 | |
| B. | 元素相对原子质量依次递增 | |
| C. | 元素原子半径大小呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
8.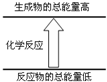 下列变化完全符合如图图示的是
下列变化完全符合如图图示的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O与NH4Cl反应( )
 下列变化完全符合如图图示的是
下列变化完全符合如图图示的是①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O与NH4Cl反应( )
| A. | ①②⑥ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ②④⑤⑦ |
5.各取1mol下列物质与溴水充分反应,消耗Br2的物质的量按①②③顺序排列正确的是( )
①漆酚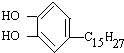
②丁香油酚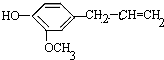
③白藜芦醇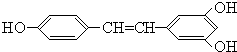
①漆酚

②丁香油酚

③白藜芦醇
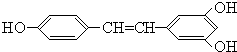
| A. | 2mol、2mol、6 mol | B. | 5mol、2mol、6 mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6 mol |
2.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+H2O=Na++OH一+H2↑ | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl一 |
3.相同物质的量的Na、Fe、Al分别跟足量的稀硫酸反应,生成的气体在同温同压下体积比为( )
| A. | 1:2:3 | B. | 46:56:27 | C. | 6:3:2 | D. | 1/23:1/28:1/9 |