题目内容
14.下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题.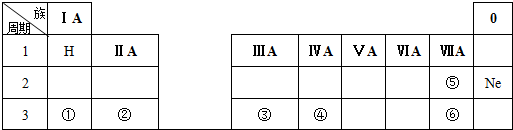
(1)元素④的符号是Si;
(2)⑤和⑥两种元素原子半径的大小关系:⑤<⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:①>②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑.
分析 (1)由元素在周期表中位置,可知①为Na、②为Mg、③为Al、④为Si、⑤为F、⑥为Cl;
(2)同主族随原子序数增大,原子半径越大;
(3)同一周期中,原子序数越大,金属性越弱;
(4)①的最高价氧化物的水化物NaOH,元素③的单质为Al,二者反应生成偏铝酸钠和氢气.
解答 解:(1)由元素在周期表中位置可知,①为Na、②为Mg、③为Al、④为Si、⑤为F、⑥为Cl,故答案为:Si;
(2)同主族随原子序数增大,原子半径越大,故原子半径F<Cl,故答案为:<;
(3)①为Na、②为Mg,二者处于同一周期,原子序数越大,金属性越弱,则金属性大小为:Na>Mg,故答案为:>;
(4)①的最高价氧化物的水化物NaOH,元素③的单质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
故答案为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑.
点评 本题考查元素周期表与元素周期律的应用,题目难度不大,试题侧重对基础知识的巩固,注意理解掌握元素周期律内容、元素周期表结构.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
5.各取1mol下列物质与溴水充分反应,消耗Br2的物质的量按①②③顺序排列正确的是( )
①漆酚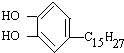
②丁香油酚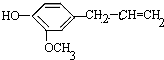
③白藜芦醇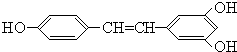
①漆酚

②丁香油酚

③白藜芦醇
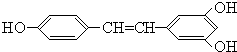
| A. | 2mol、2mol、6 mol | B. | 5mol、2mol、6 mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6 mol |
2.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+H2O=Na++OH一+H2↑ | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl一 |
9.下列关系互为同分异构体的是( )
| A. | 35 Cl和37 Cl | B. | CH3CH2OH和CH3OCH3 | ||
| C. | CH3CH3和CH3CH2CH3 | D. | H2O和H2O2 |
19.某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于( )
| A. | 原子晶体 | B. | 离子晶体 | C. | 分子晶体 | D. | 金属晶体 |
6.由甲酸甲酯、乙醛、丙酸三种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
| A. | 63% | B. | 54% | C. | 12% | D. | 9% |
3.相同物质的量的Na、Fe、Al分别跟足量的稀硫酸反应,生成的气体在同温同压下体积比为( )
| A. | 1:2:3 | B. | 46:56:27 | C. | 6:3:2 | D. | 1/23:1/28:1/9 |
4.下列说法或表示正确的是( )
| A. | NH3、H2O、PCl3都是极性分子 | B. | CO2的分子示意图: | ||
| C. | H2O2的电子式: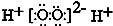 | D. | CS2、C6H6、C2H2都是直线型分子 |