题目内容
17.下列选项中,符合如图所示关系的是( )
| A. | 一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系 | |
| B. | 铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系 | |
| C. | 将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系 | |
| D. | H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系 |
分析 A.一定条件下,气体摩尔体积是定值;
B.铁在氯气中燃烧,根据原子守恒知,n(FeCl3)与n(Cl2)成正比;
C.常温下,铁和浓硫酸发生钝化现象;
D.C=$\frac{1000ρω}{M}$.
解答 解:A.气体摩尔体积受温度和压强影响,温度、压强一定,则气体摩尔体积越大,与气体的物质的量无关,故A错误;
B.铁在氯气中燃烧,根据原子守恒知,n(FeCl3)与n(Cl2)成正比,所以其之间的关系符合图象,故B正确;
C.常温下,铁和浓硫酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,故C错误;
D.根据C=$\frac{1000ρω}{M}$知,物质的量浓度与质量分数、密度都有关,所以不符合图象,故D错误;
故选B.
点评 本题考查图象分析,涉及物质的量的计算、钝化现象等,明确图象综合坐标的含义是解本题关键,注意气体摩尔体积适用范围及适用条件,为易错点.

练习册系列答案
相关题目
7.针对如表9种元素,完成以下各小题
(1)单质为有色气体的元素是氯(填名称).
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为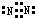 .
.
(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为
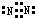 .
.(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
8. 下列变化完全符合如图图示的是
下列变化完全符合如图图示的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O与NH4Cl反应( )
 下列变化完全符合如图图示的是
下列变化完全符合如图图示的是①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O与NH4Cl反应( )
| A. | ①②⑥ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ②④⑤⑦ |
5.各取1mol下列物质与溴水充分反应,消耗Br2的物质的量按①②③顺序排列正确的是( )
①漆酚
②丁香油酚
③白藜芦醇
①漆酚

②丁香油酚

③白藜芦醇

| A. | 2mol、2mol、6 mol | B. | 5mol、2mol、6 mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6 mol |
12.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和 O2+2H2O+4e-═4OH-.则下列叙述正确的是( )
| A. | 通H2的一极是正极 | |
| B. | 通O2的一端极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作一段时间后电解质溶液pH减小 |
2.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+H2O=Na++OH一+H2↑ | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl一 |
9.下列关系互为同分异构体的是( )
| A. | 35 Cl和37 Cl | B. | CH3CH2OH和CH3OCH3 | ||
| C. | CH3CH3和CH3CH2CH3 | D. | H2O和H2O2 |
6.由甲酸甲酯、乙醛、丙酸三种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
| A. | 63% | B. | 54% | C. | 12% | D. | 9% |
7.几种短周期元素的原子半径及主要化合价如表:下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | X单质可在氧气中燃烧生成XO3 | |
| C. | 离子半径大小:r (M3+)>r (T2-) | |
| D. | L2+和X2-的核外电子数相等 |