题目内容
12.能用浓硫酸干燥的气体是( )| A. | HI | B. | NH3 | C. | SO2 | D. | H2S |
分析 浓硫酸属于酸,具有酸的通性,还具有吸水性、脱水性和强氧化性,能干燥中性或酸性气体,但不能干燥碱性、部分强还原性气体,据此分析解答.
解答 解:A.HI气体能被浓硫酸氧化,所以不能用浓硫酸干燥,故A错误;
B.氨气属于碱性气体,能被浓硫酸吸收,所以不能被浓硫酸干燥,故B错误;
C.二SO2属于酸性氧化物,和浓硫酸不反应,所以能被浓硫酸干燥,故C正确;
D.硫化氢气体能被浓硫酸氧化,H2S+H2SO4(浓)═SO2+S↓+2H2O,所以不能用浓硫酸干燥,故D错误;
故选C.
点评 本题以浓硫酸的性质为载体考查了气体的干燥,难度不大,只有物质之间不反应时,气体才能被这种干燥剂干燥,如:酸性干燥剂不能干燥碱性气体,碱性干燥剂不能干燥酸性气体.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
2.下列分子的VSEPR模型与分子的立体构型相同的是( )
| A. | H2O | B. | SO32- | C. | NH3 | D. | CCl4 |
3.氯化钠是日常生活中人们常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是( )
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
20.化学式为C8H16O2的有机物A在酸性条件下能水解生成C和D,且C在一定条件下能转化为D,则有机物A的结构可能有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
7.针对如表9种元素,完成以下各小题
(1)单质为有色气体的元素是氯(填名称).
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为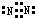 .
.
(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为
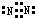 .
.(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
17.下列试剂:①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银,其中必须用棕色试剂瓶盛装的有( )
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑤ |
1.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子核外电子层排布呈周期性变化 | |
| B. | 元素相对原子质量依次递增 | |
| C. | 元素原子半径大小呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
2.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+H2O=Na++OH一+H2↑ | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl一 |