题目内容
11.在容积不变的密闭容器中存在如下反应:2A(g)+B(g)?3C(g);△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )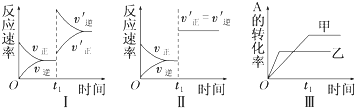
| A. | 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
分析 A、增大反应物的浓度,正逆反应速率均增大,但是在增大的瞬间,逆反应速率不变;
B、催化剂只改变反应速率,不影响平衡的移动,对反应前后气体体积不变的反应,增大压强,也只改变反应速率,不影响平衡的移动;
C、升高温度,化学平衡向着吸热方向进行;
D、催化剂只改变反应速率,不影响平衡的移动.
解答 解:A、增大反应物的浓度,正逆反应速率均增大,但是在增大的瞬间,逆反应速率不变,所以逆反应速率在t1时刻不变,不会离开原平衡点,故A错误;
B、催化剂只改变反应速率,不影响平衡的移动,和本图结果一样,该反应前后气体体积不变的反应,增大压强,也只改变反应速率,不影响平衡的移动,和本图结果一样,故B错误;
C、升高温度,化学平衡向着逆方向进行,反应物A的转化率减小,A的转化率在图中是乙<甲,所以乙的温度较高,故C正确;
D、催化剂只改变反应速率,不影响平衡的移动,各物质的转化率不变,故D错误.
故选C.
点评 本题是一道有关化学反应速率和化学平衡知识的图象题,注意固定变量法的运用,难度较大,考查角度广.

练习册系列答案
相关题目
1.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子核外电子层排布呈周期性变化 | |
| B. | 元素相对原子质量依次递增 | |
| C. | 元素原子半径大小呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
2.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+H2O=Na++OH一+H2↑ | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH一=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl一 |
19.某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于( )
| A. | 原子晶体 | B. | 离子晶体 | C. | 分子晶体 | D. | 金属晶体 |
6.由甲酸甲酯、乙醛、丙酸三种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
| A. | 63% | B. | 54% | C. | 12% | D. | 9% |
16.造成大气污染的SO2主要来源于( )
| A. | 自然界含硫化合物的分解和氧化 | B. | 火山喷发 | ||
| C. | 工厂排出的废气 | D. | 大量燃烧含硫燃料 |
3.相同物质的量的Na、Fe、Al分别跟足量的稀硫酸反应,生成的气体在同温同压下体积比为( )
| A. | 1:2:3 | B. | 46:56:27 | C. | 6:3:2 | D. | 1/23:1/28:1/9 |
20. A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是二周期、ⅣA族;用电子式表示A和E形成的化合物的形成过程.
(2)A、D、E、F离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O (g)$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2.该反应为吸热反应.(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;外电路中电子从Al电极流向Mg电极.
 A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)B在元素周期表中的位置是二周期、ⅣA族;用电子式表示A和E形成的化合物的形成过程.
(2)A、D、E、F离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O (g)$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2.该反应为吸热反应.(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;外电路中电子从Al电极流向Mg电极.
