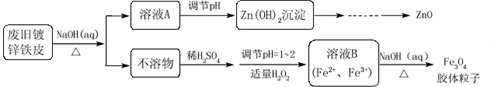
题目内容
17.明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: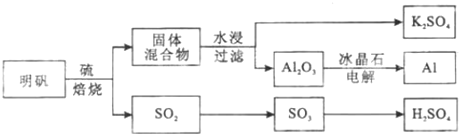
焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,转移15mol电子,生成Al2O32.5mol;
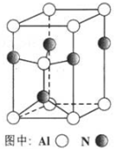
(2)A12O3在一定条件下可制得AIN,其晶体结构如下图所示,该晶体中Al的配位数是4;
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;
(4)焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol;
2H2O (g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol.
则25℃、101kPa时SO3气体与H2O反应的热化学方程式是SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol
焙烧568.8吨明矾(M=474g/mol ),若SO2 的利用率为96%,可生产质量分数为98%的硫酸259.2吨.
分析 (1)根据化学方程式确定电子转移数目与Al2O3的关系;
(2)配位化合物中直接和中心原子(或离子)相联系的配位原子的数目;
(3)以Al和NiO(OH)为电极,铝做原电池负极失电子发生氧化反应,NiO(OH)得到电子发生还原反应,结合原子守恒和电子守恒写出反应化学方程式;
(4)依据热化学方程式和盖斯定律计算得到;依据硫元素守恒计算得到.
解答 解:(1)单质S元素的化合价为0价,二氧化硫中S元素的化合价为+4价,由方程式可知生成9mol的二氧化硫转移电子的物质的量是12mol,同时生成2mol三氧化二铝,即转移电子与三氧化二铝的物质的量之比为6:1,所以转移15mol电子,生成Al2O3 2.5mol;
故答案为:2.5;
(2)依据晶体晶胞结构分析,结合配位数含义可知,每个铝原子和四个单原子相连,所以铝原子的配位数为4,
故答案为:4;
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,铝做负极失电子在氢氧化钠溶液中生成偏铝酸钠,反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 ;
故答案为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;
(4)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol①
H2O(g)?H2O(l)△H2=-44kJ/mol②
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol③
依据盖斯定律③-①-2×②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-260KJ/mol;即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
明矾的物质的量=$\frac{568.8×1{0}^{6}g}{474g/mol}$=1.2×106mol,根据方程式知,生成SO2的物质的量=$\frac{1.2×1{0}^{6}mol}{4}$×9=2.7×106mol,SO2的利用率为96%,根据硫原子守恒知,硫酸的物质的量=SO2的物质的量=2.592×106mol,则98%的质量=$\frac{2.592×1{0}^{6}mol×98g/mol}{98%}$=2.592×108g=259.2吨;
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;259.2.
点评 本题考查了氧化还原反应的分析,盖斯定律的计算,化学计算等,题目难度中等,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及化学计算能力.

| A. | 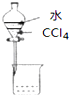 分离水和CCl4 | B. | 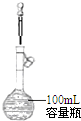 定容 | ||
| C. | 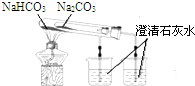 比较两种盐的热稳定性 | D. | 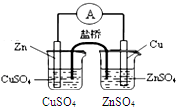 构成铜锌原电池 |
| A. | 向黄色溶液中加入淀粉,溶液变蓝色,则溶液中含有I2 | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42- | |
| C. | 用一束光照射氯化铁溶液和氢氧化铁胶体,都出现丁达尔现象 | |
| D. | 将AgNO3溶液滴入甲溶液中,若出现白色沉淀,则说明甲溶液中含有Cl- |