题目内容
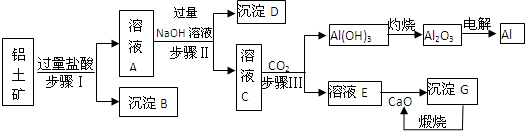
5.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO.制备流程如下: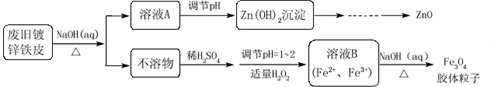
已知:Zn及其化合物的性质与Al及其化合物的性质相似.请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以溶解镀锌层.
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是抽滤→洗涤→灼烧.
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是在N2气氛下,防止Fe2+被氧化.
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量.请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O(K2Cr2O7被还原为Cr3+).
(5)若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O70.7350g(保留四位有效数字,已知M(K2Cr2O7)=294.0g•mol-1).
配制该标准溶液时,下列仪器一定不要用到的有③⑦(用编号表示).
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果偏小(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将偏大.
分析 根据实验流程图可知:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,高温灼烧氢氧化锌分解得到ZnO;
(3)持续通入N2,防止Fe2+被氧化;
(4)根据反应中Cr2O72- 被还原为Cr3+,Fe2+被氧化Fe3+,同时生成水,配平书写离子方程式;
(5)根据m=cVM计算m(K2Cr2O7);
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,用250mL容量瓶用于配置溶液,胶头滴管用于加水定容;
(6)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$对V(标准)的影响来判断.
解答 解:(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,
故答案为:溶解镀锌层;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO,
故答案为:抽滤、灼烧;
(3)Fe2+容易被氧化;持续通入N2,防止Fe2+被氧化;
故答案为:在N2气氛下,防止Fe2+被氧化;
(4)反应中Cr2O72- 被还原为Cr3+,Fe2+被氧化Fe3+,同时生成水,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(5)m(K2Cr2O7)=0.01000mol•L-1×0.250 L×294.0 g•mol-1=0.7350g;
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,用玻璃棒搅拌,恢复室温,用玻璃棒引流,移入250mL容量瓶中,继续加水至离刻度线1-2cm处,改用胶头滴管加水定容,故用不到的仪器为量筒和移液管,
故答案为:0.7350;③⑦;
(6)配制K2Cr2O7标准溶液时,俯视刻度线,溶液的体积偏小,标准溶液的浓度偏大,造成消耗的V(标准)偏小,则测定结果偏小;
滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,造成消耗的V(标准)偏大,则测定结果偏大;
故答案为:偏小;偏大.
点评 本题以物质的制备为载体,考查实验基本操作和技能,物质的性质、氧化还原反应方程式的书写以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.

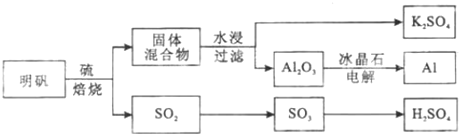
| A. | 分离苯和水的混合物,可用分液法 | |
| B. | 从Na2CO3溶液中得到Na2C03,可用过滤法 | |
| C. | 分离酒精和CCl4的混合物,可用分液法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
已知:
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$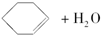

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
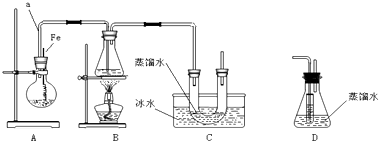
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止液体暴沸,②导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g(填g或f)口进入.蒸馏时要加入生石灰,目的是除去环己烯中少量的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出.
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
 .
.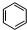 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$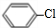 +HCl.
+HCl.
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$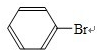 +HBr
+HBr