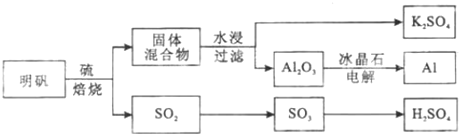
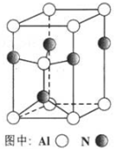
题目内容
19.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+的离子半径逐渐减小;化合物XN常温下为气体.据此回答:N的最高价氧化物对应水化物的化学式HClO4.分析 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子的质子数是Y原子的2倍,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素,以此解答该题.
解答 解:元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子的质子数是Y原子的2倍,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素,则N的最高价氧化物对应水化物的化学式为HClO4,故答案为:HClO4.
点评 本题考查结构物质性质关系应用,难度不大,根据核外电子排布规律推断元素是解题关键,侧重对基础知识的巩固.

练习册系列答案
相关题目
10.下列化合物中含有2个手性碳原子的是( )
| A. | 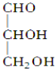 | B. | 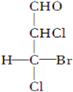 | C. | 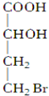 | D. | 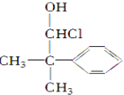 |
11.下列过程中△H大于零的是( )
| A. | 碳的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
8.下列说法中,正确的是( )
| A. | 分离苯和水的混合物,可用分液法 | |
| B. | 从Na2CO3溶液中得到Na2C03,可用过滤法 | |
| C. | 分离酒精和CCl4的混合物,可用分液法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
 .
.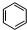 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$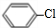 +HCl.
+HCl.